Варианты заданий для контрольных работ
| Последние две цифры шифра | Номера задач для контрольных работ | ||||
| 1 | 2 | ||||
| 1, 31, 81, 120, 131, 151, 161, 206, 216, 230 | |||||
| 2, 32, 82, 119, 132, 152, 162, 207, 217, 228 | |||||
| 3, 33, 83, 118, 133, 153, 163, 208, 218, 227 | |||||
| 4, 34, 84, 117, 134, 154, 164, 209, 219, 227 | |||||
| 5, 35, 85, 116, 135, 155, 165, 210, 220, 250 | |||||
| 6, 36, 86, 115, 136, 156, 166, 211, 221, 249 | |||||
| 7, 37, 87, 114, 137, 157, 167, 212, 222, 248 | |||||
| 8, 38, 88, 113, 138, 158, 168, 213, 223, 247 | |||||
| 9, 39, 89, 112, 139, 159, 169, 214, 224, 246 | |||||
| 10, 40, 90, 111, 140, 160, 170, 215, 225, 245 | |||||
| 11, 41, 81, 110, 141, 152, 171, 205, 226, 244 | |||||
| 12, 42, 82, 109, 142, 153, 172, 206, 225, 243 | |||||
| 13, 43, 83, 108, 143, 154, 173, 207, 224, 242 | |||||
| 14, 44, 84, 107, 144, 155, 174, 208, 223, 241 | |||||
| 15, 45, 85, 106, 145, 156, 175, 209, 222, 240 | |||||
| 16, 46, 86, 105, 146, 157, 176, 210, 221, 239 | |||||
| 17, 47, 87, 104, 147, 158, 177, 211, 220, 238 | |||||
| 18, 48, 88, 103, 148, 159, 178, 212, 219, 237 | |||||
| 19, 49, 89, 102, 149, 160, 179, 215, 218, 236 | |||||
| 20, 50, 90, 101, 150, 151, 180, 214, 217, 235 | |||||
| 21, 51, 81, 130, 131, 153, 181, 213, 216, 234 | |||||
| 22, 52, 82, 129, 132, 154, 182, 211, 217, 233 | |||||
| 23, 53, 83, 128, 133, 155, 183, 210, 218, 232 | |||||
| 24, 54, 84, 127, 134, 156, 184, 209, 219, 231 | |||||
| 1 |
| ||||
| 25, 55, 85, 126, 135, 157, 185, 208, 220, 230 | |||||
| 26, 56, 86, 125, 136, 158, 186, 207, 221, 229 | |||||
| 27, 57, 87, 124, 137, 159, 187, 206, 222, 228 | |||||
| 28, 58, 88, 123, 138, 160, 188, 205, 223, 227 | |||||
| 29, 59, 89, 122, 139, 151, 189, 215, 224, 250 | |||||
| 30, 60, 90, 121, 140, 152, 190, 214, 225, 249 | |||||
| 1, 61, 85, 120, 141, 154, 191, 213, 226, 248 | |||||
| 2, 62, 86, 119, 142, 155, 192, 112, 216, 247 | |||||
| 3, 63, 87, 118, 143, 156, 193, 205, 217, 246 | |||||
| 4, 64, 88, 117, 144, 157, 194, 206, 218, 245 | |||||
| 5, 65, 89, 116, 145, 158, 195, 207, 219, 244 | |||||
| 6, 66, 90, 115, 146, 159, 196, 208, 220, 243 | |||||
| 7, 67, 81, 114, 147, 160, 197, 209, 221, 242 | |||||
| 8, 68, 82, 113, 148, 151, 198, 210, 222, 241 | |||||
| 9, 69, 83, 112, 149, 152, 199, 211, 223, 240 | |||||
| 10, 70, 84, 111, 150, 153, 200, 212, 224, 239 | |||||
| 11, 71, 90, 110, 141, 155, 201, 213, 225, 238 | |||||
| 12, 72, 89, 109, 142, 156, 202, 214, 226, 237 | |||||
| 13, 73, 88, 108, 143, 157, 203, 215, 218, 236 | |||||
| 14, 74, 87, 107, 144, 158, 204, 214, 219, 235 | |||||
| 15, 75, 86, 106, 145, 159, 205, 213, 220, 234 | |||||
| 16, 76, 85, 105, 146, 160, 201, 212, 221, 233 | |||||
| 17, 77, 84, 104, 147, 151, 202, 211, 222, 232 | |||||
| 18, 78, 83, 103, 148, 152, 203, 209, 223, 231 | |||||
| 19, 79, 82, 102, 149, 153, 204, 208, 224, 230 | |||||
| 20, 80, 81, 101, 150, 154, 161, 207, 225, 229 | |||||
| 21, 51, 82, 100, 140, 155, 162, 206, 226, 228 | |||||
| 1 |
| ||||
| 22, 52, 88, 99, 139, 156, 163, 205, 216, 227 | |||||
| 23, 53, 89, 98, 138, 157, 164, 215, 217, 250 | |||||
| 24, 54, 90, 97, 137, 158, 165, 214, 218, 249 | |||||
| 25, 55, 87, 96, 136, 159, 166, 213, 219, 248 | |||||
| 26, 56, 86, 95, 135, 160, 167, 212, 220, 247 | |||||
| 27, 57, 85, 94, 134, 151, 168, 211, 221, 246 | |||||
| 28, 58, 84, 93, 132, 152, 169, 210, 222, 245 | |||||
| 29, 59, 83, 92, 133, 153, 170, 215, 223, 244 | |||||
| 30, 60, 82, 91, 131, 154, 171, 214, 224, 243 | |||||
| 1, 61, 81, 130,150, 155, 172, 213, 225, 242 | |||||
| 2, 62, 90, 129, 149, 157, 173, 212, 226, 241 | |||||
| 3, 63, 89, 128, 148, 158, 174, 211, 216, 240 | |||||
| 4, 64, 88, 127, 147, 159, 175, 210, 217, 239 | |||||
| 5, 65, 87, 126, 146, 160, 176, 209, 218, 238 | |||||
| 6, 66, 86, 125, 145, 151, 177, 208, 219, 237 | |||||
| 7, 67, 85, 124, 144, 152, 178, 207, 220, 236 | |||||
| 8, 68, 84, 123, 143, 153, 179, 206, 221, 235 | |||||
| 9, 69, 83, 122, 142, 154, 180, 205, 222, 234 | |||||
| 10, 70, 82, 121, 141, 155, 181, 215, 223, 233 | |||||
| 11, 71, 81, 120, 140, 156, 182, 214, 224, 232 | |||||
| 12, 72, 89, 119, 139, 157, 183, 213, 225, 231 | |||||
| 13, 73, 90, 118, 138, 158, 184, 212, 226, 230 | |||||
| 14, 74, 88, 117, 137, 159, 185, 211, 225, 229 | |||||
| 15, 75, 87, 116, 136, 160, 186, 210, 224, 228 | |||||
| 16, 76, 86, 115, 135, 158, 187, 209, 223, 227 | |||||
| 17, 77, 85, 114, 134, 159, 188, 208, 222, 250 | |||||
| 18, 78, 84, 113, 133, 160, 189, 207, 221, 249 | |||||
| 1 |
| ||||
| 19, 79, 83, 112, 132, 151, 190, 205, 220, 248 | |||||
| 20, 80, 82, 111, 131, 152, 191, 215, 219, 247 | |||||
| 21, 31, 81, 110, 145, 153, 192, 214, 218, 246 | |||||
| 22, 32, 89, 109, 146, 154, 193, 213, 217, 245 | |||||
| 23, 33, 90, 108, 147, 155, 194, 212, 216, 244 | |||||
| 24, 34, 89, 107, 148, 156, 195, 211, 220, 243 | |||||
| 25, 35, 88, 106, 149, 157, 196, 210, 221, 242 | |||||
| 26, 36, 87, 105, 150, 158, 197, 209, 222, 241 | |||||
| 27, 37, 86, 104, 144, 160, 198, 208, 223, 240 | |||||
| 28, 38, 85, 103, 143, 159, 199, 207, 224, 239 | |||||
| 29, 39, 84, 102, 142, 160, 200, 206, 225, 238 | |||||
| 30, 40, 83, 101, 141, 159, 201, 215, 226, 237 | |||||
| 1, 51, 82, 100, 135, 158, 202, 214, 219, 236 | |||||
| 2, 52, 81, 99, 136, 157, 203, 213, 218, 235 | |||||
| 3, 53, 90, 98, 137, 156, 204, 212, 217, 234 | |||||
| 4, 54, 89, 97, 138, 155, 180, 211, 216, 233 | |||||
| 5, 55, 88, 96, 139, 154, 181, 210, 219, 232 | |||||
| 6, 56, 87, 95, 140, 153, 182, 209, 216, 231 | |||||
| 7, 57, 86, 94, 131, 152, 183, 208, 226, 230 | |||||
| 8, 58, 85, 93, 132, 151, 184, 207, 225, 229 | |||||
| 9, 59, 84, 92, 133, 160, 185, 206, 224, 228 | |||||
| 10, 60, 83, 91, 134, 159, 186, 205, 222, 227 |
26. Укажите, в чем различие и сходство между газообразным, жидким и твердым состоянием. Какие из собственных характеристик вещества влияют на его агрегатное состояние?
27. Назовите переходы от одного агрегатного состояния в другое. Опишите явления, сопровождающие эти переходы, возможные изменения плотности (объема) вещества и тепловые эффекты.
28. Приведите доказательство молекулярного строения газов.
29. Докажите, что температура и давление, входящие в уравнение состояния идеального газа, являются абсолютными величинами.
30. Какой физический смысл имеет универсальная газовая постоянная? каковы ее возможные размерности? Рассчитайте, пользуясь уравнением Менделеева - Клайперона, объем одного моля газа при н.у. (Р – 1атм., температура – 00С).
31. Углекислый газ находится в баллоне емкостью 100л при 250С под давлением 0,5 атм. Можно ли его считать идеальным? Рассчитайте имеющееся количество СО2 в молях и килограммах. Каким уравнением состояния можно описать этот газ?
32. Приведите свойства, отличающие реальный газ от идеального.
33. Объясните на основании кинетической теории и межмолекулярного взаимодействия различие между жидкостью и газом.
34. Почему жидкости практически не сжимаемы? Какое давление необходимо, чтобы произошло значительное сжатие жидкости?
35. Объясните, почему не возможно существование жидкости при температуре выше критической?
36. Как влияет присутствие примесей в жидкости на коэффициент поверхностного натяжения?
37. В чем состоит различие между аморфными и кристаллическими телами?
38. В чем заключается различие связей в кристаллах ионного и атомного типов?
39. Как влияет на взаимную растворимость двух жидкостей введение в систему третьего компонента?
40. Чем объясняется возможность повышения и уменьшения растворимости твёрдых веществ с ростом температуры?
41. Как влияет полярность вещества на их взаимную растворимость?
42. В результате какого процесса происходит засахаривание варенья?
43. Почему водный раствор, в котором массовая доля NaCl составляет 0,86% называют физиологическим? Почему раны предпочтительнее промывать этим раствором, а не водой?
44. Каково должно быть соотношение числа растворенных частиц в двух растворах, если осмотические давления этих растворов относятся друг к другу как 1:150 (Т=const, V1/V2 = 2)?
45. Раствор анилина в воде изотоничен 0,32% раствору метилового спирта (ρ=1г/см3). При какой температуре будет замерзать этот раствор?
46. Какое количество сахара надо растворить в 1 л воды, чтобы температура кипения увеличилась на 1оС?
47. При растворении 145 мг белка в 100 см3 воды при 25 оС возникает осмотическое давление 0,00985 атм. Какова молекулярная масса этого белка? Охарактеризуйте коллигативные свойства разбавленных растворов.
48. Дайте определение осмосу и осмотическому давлению растворов. Сформулируйте закон Вант-Гоффа. Каково значение осмоса в жизнедеятельности живых организмов и растений (понятие о тургоре и плазмолизе).
|
|
|
49. Опишите осмотические процессы, происходящие при заваривании пакетированного чая.
50. Что такое процесс экстракции? Какую роль он играет в общественном питании? Приведите пример.
51. Благодаря чему происходит очищение воды при многократных циклах её замораживания и размораживания?
52. Сформулируйте закон Гесса. Сколько тепла можно получить от сжигания 80 г метана? Теплота сгорания метана равна 212,76 ккал/моль.
53. Укажите связь закона Гесса с первым законом термодинамики. Определите стандартную теплоту образования метана (∆ Н0 обр.) по следующим данным: теплота сгорания метана (∆ Н0 сгор.) равна – 212,8 ккал, теплота образования СО2 и Н2О (∆ Н0 обр.) равна соответственно – 94,05 и - 68,32.
54. Что такое параметр состояния? Какие параметры состояния термодинамической системы являются интенсивными, экстенсивными?
55. Каково статистическое толкование понятия энтропия? Как изменяется энтропия в процессе жизнедеятельно и гибели живого организма как открытой системы?
56. Укажите, увеличится или уменьшится энтропия в следующих процессах: плавление льда, разложение N2O4 (N2O4 = 2NO2), получение аммиака (N2 + 3H2 = 2NH3), растворение поваренной соли в воде. Дайте объяснения на основе представлений об изменении степени упорядоченности в этих системах.
57. Определите изменение энтропии при плавлении 0,1 моля льда и при испарении этого количества воды, удельная теплота плавления 80 кал/г, удельная теплота испарения 539 кал/г.
58. Вычислите теплоту образования метилового спирта при 250С:
С + 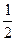 О2 + 2 Н2 = CH3OH из данных значений ∆H0 для реакций: CH3OH +
О2 + 2 Н2 = CH3OH из данных значений ∆H0 для реакций: CH3OH + 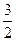 О2 = СО2 + 2H2O ∆H01 = -173,65 ккал С + О2 = СО2 ∆H02 = -94,05 ккал H2 +
О2 = СО2 + 2H2O ∆H01 = -173,65 ккал С + О2 = СО2 ∆H02 = -94,05 ккал H2 + 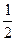 O2 = H2O ∆H03 = - 68,3 ккал
O2 = H2O ∆H03 = - 68,3 ккал
59. Вычислите теплоту гидролиза мальтозы при постоянном давлении:
C12H22O11 + H2O = 2C6H12O6 ∆H0x =?
если известны теплоты сгорания мальтозы и глюкозы:
C12H22O11 + 12О2 = 12CO2 +11H2O ∆H01 = -1350,2 ккал
C6H12O6 + 6O2 = 6СО2 + 6H2O ∆H02 = -673,0 ккал
60. Определите тепловой эффект реакции (∆H р-ции): CaO + H2O = Ca(OH)2, если теплоты образования CaO, H2O и Ca(OH)2 (∆ Н0 обр.) соответственно равны – 157,7 ккал,- 68,32 ккал и 235,8 ккал.
|
|
|
61. Вычислите изменение стандартной энтропии образования уксусной кислоты из элементов (∆S0обр.) из данных абсолютных энтропий веществ при 250С:
Вещество S0 кал/моль град
С 1,361
Н2 31,21
О2 49,0
СH3COOH 38,2
62. Вычислите стандартную теплоту образования уксусной кислоты
при 250С: 2C + 2H2 + O2 = CH3COOH ∆H0x =? из значений ∆H0 для реакций: CH3COOH + 2O2 = 2CO2 + 2H2O ∆H01 = -208,34 ккал С + О2 = СО2 ∆H02 = -94,05 ккал H2 + 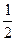 O2 = H2O ∆H03 = - 68,3 ккал
O2 = H2O ∆H03 = - 68,3 ккал
63. Определите стандартную энтальпию образования пентахлорида фосфора, исходя из уравнений реакций:
2P + 3Cl2= 2PCl + 554,0 кДж
PCl3+ Сl2 = PCl5 + 137,4кДж
64. Дайте определение ионному произведению воды и рН. Охарактеризуйте колориметрический метод определения рН.
65. При 750С давление пара воды равно 385 гПа. Оно понизилось на 4,92гПа при растворении в 100 г воды 2,2 г хлорида аммония. Вычислить кажущуюся степень диссоциации NH4Cl в этом растворе.
66. В водном растворе при Т =310 К растворено 8.8 г/л хлорида натрия. Кажущаяся степень диссоциации NaCl 98%. Определить осмотическое давление и изотонический коэффициент.
67. Сколько надо взять г воды и алюмокалиевых квасцов, чтобы получить после перекристаллизации 20 г чистой соли, если насыщение вести при 60 оС, а кристаллизацию - при 0 оС.
68. 59,1 г K2MnO4 обработали 500 мл воды. Сколько граммов перманганата калия KMnO4 можно получить, если отфильтровать образовавшийся MnO2 и охладить фильтрат до 0 оС. Реакция протекает по уравнению:
3 K2MnO4 + 2 H2O = 2 KMnO4 + MnO2 + 4KOH
69. Составьте методику очистки от растворимых примесей методом перекристаллизации гидроксида бария и карбоната лития.
70. Рассчитайте степень диссоциации 0,1М раствора азотистой кислоты.
Кд = 4⋅104.
71. Вычислите рН 0,01М раствора сероводорода. К1 = 9⋅10-8, К2 = 10-15.
72. Вычислите рН 0,01М раствора аммиака Кд(NH4OH) = 2⋅10-5.
73. Определите концентрацию синильной кислоты, при которой степень ее диссоциации равна 0.0001% (Кд = 7⋅10-10).
74. Вычислите рН насыщенного раствора гидроксида магния при
ПР = 5⋅10-12.
75. Произведение растворимости гидроксида магния при 25 оС равно 5⋅10-12. Какова растворимость этого соединения?
76. Растворимость гидроксида некоторого двухвалентного металла равна 3.75⋅10-5 моль/л. Каково его произведение растворимости?
77. Определите, на какой глубине в море в подводной лодке можно добывать пресную воду, используя явление осмоса. Считать состав морской воды в пересчете на NaCl 5,13%, степень диссоциации NaCl =1, а ρ = 1,04 г/см3.
78. Растворимость сульфата калия в воде равна 1.06 г/л. Какова будет растворимость этого соединения в 0,1М растворе сульфата калия?
79. Рассчитайте рН буферного раствора, содержащего 2.0 М растворы хлорида аммония и аммиака. Кд(NH4OH) = 2⋅10-5
80. Как измениться степень гидролиза 0.1 М раствора цианида калия при добавлении к нему 0,01 моля серной кислоты на литр? Кд = 7⋅10-10.
81. Как измениться рН 100 мл раствора, содержащего по 0.5 моль ацетата натрия и уксусной кислоты при добавлении к нему 11.2 г гидроксида калия. Изменением объема пренебречь. Кд = (СН3СООН) = 2⋅10-5.
82. Произведение растворимости некоторой соли АХ, образованной сильной кислотой и слабым основанием равно 10-4. Определите рН насыщенного раствора этой соли, если константа диссоциации основания АОН равна 10-4.
83. Определите концентрацию раствора щелочи, при взаимодействии которой с эквивалентным объемом 2М уксусной кислоты рН раствора стал равен 5. Кд = (СН3СООН) = 2⋅10-5.
84. Вычислите рН раствора, образующегося в результате полного поглощения в 0,5 л воды газообразных продуктов термического разложения соли, полученной выпариванием 3л насыщенного раствора MgNH2PO4
(ПР=2,5 ∙10-13).
85. К 1 л насыщенного раствора (NH4)2IrCl6 (ПР=3,0 ∙10-5) прибавили избыток концентрированного раствора щелочи, при этом выделился газ и выпал осадок. Выделившийся газ пропустили над нагретым оксидом меди. Определите количество образовавшегося при этом газообразного продукта. Определите количество выпавшего осадка Ir(Cl)4 (ПР=1,6 ∙10-13).
86. Растворимость AgPO4 в воде при 20оС равна 0,0065 г/л. Рассчитайте величину ПР этой соли.
87. Раствор, содержащий 0,512г неэлектролита в 100 г бензола, кристаллизуется при 5,296оС. Температура кристаллизации бензола 5,5оС. Криоскопическая константа 5,1о. Вычислите мольную массу растворенного вещества.
Ответ: 128 г/моль.
88. Вычислите процентную концентрацию водного раствора сахара С12Н22О11, зная, что температура кристаллизации раствора -0,93оС. Криоскопическая константа воды 1,86о.
Ответ: 14,6%.
89. Вычислите температуру кристаллизации раствора мочевины (NH2)2СО, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды 1,86о.
Ответ: -1,030.
90. Раствор, содержащий 3,04 г камфоры С10Н16О в 100 г бензола, кипит при 80,714оС. Температура кипения бензола 80,2оС. Вычислите эбуллиоскопическую константу бензола.
Ответ: 2,57о.
91. Вычислите процентную концентрацию водного раствора глицерина С3Н5(ОН)3, зная, что этот раствор кипит при 100,39оС. Эбуллиоскопическая константа воды 0,52о.
Ответ: 6,45%.
92. Вычислите мольную массу неэлектролита, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при -0,279оС. Криоскопическая константа воды 1,86о.
Ответ: 60 г/моль.
93. Вычислите температуру кипения 5%-ного раствора нафталина С10Н8 в бензоле. Температура кипения бензола 80,2оС. Эбуллиоскопическая константа его 2,57о.
Ответ: 81,25оС.
94. Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при -0,465оС. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86о.
Ответ: 342 г/моль.
95. Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 4,25 г антрацена С14Н10 в 100 г уксусной кислоты, кристаллизуется при 15,718оС. температура кристаллизации уксусной кислоты 16,65оС.
Ответ: 3,9о.
96. При растворении 4,86 г серы в 60 г бензола температура кипения его повысилась на 0,81о. Сколько атомов содержит молекула серы в этом растворе. Эбуллиоскопическая константа бензола 2,57о.
Ответ: 8.
97. Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды, равна -0,558оС. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86о.
Ответ: 442 г/моль.
98. Какую массу анилина С6Н5NH2 следует растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,53о. Эбуллиоскопическая константа этилового эфира 2,12о.
Ответ: 1,16 г.
99. Вычислите температуру кристаллизации 2%-ного раствора этилового спирта С2Н2ОН. Криоскопическая константа воды 1,86о.
Ответ: -0,82оС.
100. Сколько граммов мочевины (NH2)2СО следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,465о? Криоскопическая константа воды 1,86о.
Ответ: 1,12 г.
101. Вычислите процентную концентрацию водного раствора глюкозы С6Н12О6, зная, что этот раствор кипит при 100,26оС. Эбуллиоскопическая константа воды 0,52о.
Ответ: 8,25%.
102. Сколько граммов фенола С6Н5ОН следует растворить в 125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,7о? Криоскопическая константа бензола 5,1о.
Ответ: 3,91 г.
103. Сколько граммов мочевины (NH2)2СО следует растворить в 250 г воды, чтобы температура кипения повысилась на 0,26о? Эбуллиоскопическая константа воды 0,52о.
Ответ: 7,5 г.
104. При растворении 2,3 г некоторого неэлектролита в 125 г воды температура кристаллизации понижается на 0,372о. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86о.
Ответ: 92 г/моль.
105. Вычислите температуру кипения 15%-ного водного раствора пропилового спирта С3Н7ОН. Эбуллиоскопическая константа воды 0,52о.
Ответ: 101,52оС.
106. Сколько мл 5 %-ного раствора аммиака надо добавить к 10 мл 0,10 М раствора соляной кислоты, чтобы получить буферную смесь с рН 9,5?
Рассчитайте буферную емкость полученного раствора.
107. Рассчитайте рН и буферную емкость раствора, полученного смешением 100,0 мл 0,123 М уксусной кислоты и 2,3 г ацетата натрия.
108. Сколько мл 15 %-ного раствора аммиака надо прилить к 20 мл 0,20 М раствора соляной кислоты, чтобы получить буферную смесь с рН 8,5?
109. К 100,0 мл 1,6 М раствора уксусной кислоты добавили 2,45 г ацетата натрия марки «хч» (98 % основного вещества) и разбавили полученный раствор до 250,0 мл водой. Рассчитайте рН и буферную емкость полученного раствора.
110. Сколько мл 6,3 М раствора уксусной кислоты надо прилить к 30 мл 1,2 М раствора гидроксида калия, чтобы получить буферный раствор с рН 4,18?
111. Рассчитайте рН и буферную емкость раствора, полученного смешением 20,0 мл 25 %-ного раствора аммиака и 20,0 мл 1,4 М раствора соляной кислоты.
112. Сколько мл 15 %-ного раствора аммиака надо прилить к 50 мл 0,10 М раствора соляной кислоты, чтобы получить буферную смесь с рН 9,5? Рассчитайте буферную емкость полученного раствора.
113. Рассчитайте рН и буферную емкость раствора, полученного смешением 50,0 мл 0,15 М уксусной кислоты и 2,3 г ацетата натрия.
114. Сколько мл 15 %-ного раствора аммиака надо прилить к 50 мл 0,20 М раствора соляной кислоты, чтобы получить буферную смесь с рН 8,7?
115. Сколько мл уксусной кислоты (ω = 36,2 %, ρ = 1,045 г/мл) надо прилить к 40 мл 1,2 М раствора гидроксида калия, чтобы получить буферный раствор с рН 4,30?
116. Рассчитайте рН и буферную емкость раствора, полученного смешением 50,0 мл 25 %-ного раствора аммиака и 30,0 мл 1,4 М раствора соляной кислоты.
117. Сколько мл раствора уксусной кислоты (ω = 36,2 %, ρ = 1,045 г/мл) надо прилить к 50 мл 1,2 М раствора гидроксида калия, чтобы получить буферный раствор с рН 4,5?
118. Рассчитайте рН и буферную емкость раствора, полученного смешением 22,0 мл 25 % -ного раствора аммиака и 25,0 мл 1,4 М раствора соляной кислоты.
119. Сколько мл 24 %-ного раствора аммиака надо прилить к 100 мл 0,10 М раствора соляной кислоты, чтобы получить буферную смесь с рН 9,5? Рассчитайте буферную емкость полученного раствора.
120. Рассчитать рН и буферную емкость раствора, полученного смешением 50,0 мл 0,55 %-ной уксусной кислоты и 2,3 г ацетата натрия.
121. Сколько мл 18 %-ного раствора аммиака надо прилить к 50 мл 0,22 М раствора соляной кислоты, чтобы получить буферную смесь с рН 8,7?
122. К 100,0 мл 1,6 % раствора уксусной кислоты добавили 2,5 г ацетата натрия. Рассчитайте рН и буферную емкость полученного раствора.
123. Сколько мл 15 %-ного раствора аммиака надо прилить к 50 мл 0,20 М раствора соляной кислоты, чтобы получить буферную смесь с рН 8,7?
124. Рассчитайте рН и буферную емкость раствора, полученного смешением 50,0 мл 0,15 М уксусной кислоты и 2,3 г ацетата натрия.
125. Что означает термин «электропроводимость», «удельная электропроводимость. Какова размерность этой величины? От каких величин она зависит?
126. Дайте характеристику: удельная и эквивалентная электропроводность для сильных и слабых электролитов; их зависимость от концентрации; уравнение Онзагера.
127. Опишите применение закона действующих масс к электролитам. Закон разведения Оствальда.
128. Дайте характеристику: абсолютные скорости и подвижности ионов. Закон Кольрауша.
129. Дайте характеристику: активность и коэффициент активности. Закон ионной силы.
130. Дайте характеристику: электродный потенциал. Вывод формулы Нернста.
131. Дайте характеристику: гальванический элемент. Э.Д.С. гальванического элемента.
132. Дайте характеристику: химические и концентрационные цепи. Приведите пример расчета Э.Д.С.
133. Дайте характеристику: электролиз. Законы Фарадея.
134. Что означает термин «эквивалентная электропроводимость»? Какова размерность этой величины? Каково соотношение между удельной и эквивалентной электропроводимостью? Как влияет разбавление на величину удельной и эквивалентной электропроводимости?
135. Как влияет температура на величину электропроводимости?
136. Что означает термин «абсолютная скорость движения ионов»? Какова размерность этой величины?
137. Какова причина аномальной подвижности ионов (НзО)+?
138. Каково соотношение между абсолютной скоростью движения ионов и подвижностью? Сформулируйте закон Кольрауша.
139. Каковы основные положения теории Аррениуса? Приведите формулу для нахождения электролитической диссоциации по электропроводности для слабых электролитов.
140. В чем состоит закон разведения Оствальда?
141. Приведите примеры использования измерений электропроводности в общественном питании.
142. В сосуд помещены электроды с поверхностью 2.5 см2. Расстояние между ними 5 см. Сосуд заполнен раствором 0.1 М КОН. При напряжении 6 В через раствор идет ток 0.02 А. Определите удельную и эквивалентную электропроводность.
143. При электролизе водного раствора SnCl2 на аноде выделилось 4.48 л хлора (н.у.). Найдите массу выделившегося на катоде олова. Электрохимический эквивалент хлора К э = 0.37×10-3 г/кул.
144. Составьте схему кадмиево-цинкового гальванического элемента и вычислите константу равновесия реакции, протекающей в этом элементе. Стандартные электродные потенциалы цинка и кадмия равны:
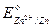 = - 0.763 В,
= - 0.763 В, 
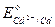 = - 0.403 В. Т =298 К.
= - 0.403 В. Т =298 К.
145. В два сосуда с голубым раствором медного купороса поместили в первый цинковую пластинку, а во второй серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярное уравнения соответствующей реакции.
146. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: а) СuSO4; б) MgSO4; в) Pb(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
147. При какой концентрации ионов Zn2+ (в моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала?
Ответ: 0,30 моль/л.
148. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: а) AgNO3; б) ZnSO4; в) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
149. Марганцевый электрод в растворе его соли имеет потенциал -1,23В. Вычислите концентрацию ионов Mn2+ (в моль/л).
Ответ: 1,89∙ 10-5 моль/л.
150. Потенциал серебряного электрода в растворе AgNO3 составил 95% от значения его стандартного электродного потенциала. Чему равна концентрация ионов Ag+ (в моль/л)?
Ответ: 0,20 моль/л.
151. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС медно-кадмиевого гальванического элемента, в котором [Cd2+] = 0,8 моль/л, а [Cu2+] = 0,01 моль/л.
Ответ: 0,68 В.
152. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом - анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
153. При какой концентрации ионов Сu2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода?
Ответ: 1,89∙ 10-12 моль/л.
154. Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в 0,01 н., а второй в 0,1 н. растворы AgNO3.
Ответ: 0,059 В.
155. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод в 0,01 М растворе сульфата никеля.
Ответ: 0,0295 В.
156. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Pb2+]=[Mg2+]=0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз?
Ответ: 2,244 В.
157. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Mg2+]=[Cd2+]=1 моль/л. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л?
Ответ: 1,967 В.
158. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (моль/л), чтобы ЭДС элемента стала равной нулю, если [Zn2+]=0,001 моль/л?
Ответ: 7,3 ∙ 10-15 моль/л.
159. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению Ni + Pb(NO3)2 = Ni(NO3)2 + Pb. Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Ni2+] = 0,01 моль/л, [Pb2+] = 0,0001 моль/л.
Ответ: 0,064 В.
160. Электролиз раствора К2SO4 проводили при силе тока 5А в течение 3ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде?
Ответ: 5,03 г; 6,266 л; 3,133 л.
161. Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
162. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
163. В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.
164. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний - никель. Какие продукты коррозии образуются в первом и во втором случаях?
165. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа?
166. Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
167. Приведите формулировки и математические выражения первого закона термодинамики для изохорного, изобарного, изотермического и адиабатического процессов.
168. Дайте определение функциям состояния (внутренняя энергия, энтальпия, энтропия, изохорно- и изобарно-изотермические потенциалы). Раскройте их физический смысл, применение.
169. Охарактеризуйте: тепловой эффект реакции; теплоты образования, сгорания, нейтрализации, растворения. Приведите формулировку закона Гесса.
170. Охарактеризуйте зависимость теплового эффекта химической реакции от температуры. Приведите вывод уравнения Кирхгофа в интегральной форме.
171. Сформулируйте второй закон термодинамики, его значение в физической химии. Приведите его математическое выражение.
172. Охарактеризуйте: направленность самопроизвольных процессов; понятие об энтропии; изменение энтропии обратимых и необратимых процессов. Докажите несостоятельность концепции о тепловой смерти вселенной.
173. Охарактеризуйте: энергию Гиббса и энергию Гельмгольца химической реакции, их значение в физической химии. Приведите способы их расчета.
174. Охарактеризуйте изотерму химической реакции Вант-Гоффа и ее применение для определения направления протекания химических реакций.
175. Охарактеризуйте максимальную и максимальную полезную работу изотермического процесса.
176. Один моль идеального газа взятого при 25оС и 100 атм, расширяется обратимо и изотермически до 5 атм. Рассчитайте работу, поглощенную теплоту, D U, D H.
177. Один моль паров брома обратимо и изотермически сконденсировали в жидкость при 59оС. Рассчитайте работу, теплоту, изменение внутренней энергии и энтальпии в этом процессе. Удельная теплота испарения брома при этой температуре равна 184.1 Дж/г.
153. Рассчитайте максимальную полезную работу, которую можно получить в топливном элементе в результате реакции сгорания метана при 298 К.
154. Рассчитайте температуру замерзания водного раствора, содержащего 50.0 г этиленгликоля в 500 г воды.
155. Раствор, содержащий 0.81 г углеводорода Н(СН2) n H и 190 г бромистого этила, замерзает при 9.47°С. Температура замерзания бромистого этила 10°С, криоскопическая постоянная 12.5 К×кг/моль. Рассчитайте n.
156. Система, в которой протекает экзотермическая реакция СО(г) + 2Н2(г) = СН3ОН(г) находится в равновесии при 500 К и 10×105 Па. Как увеличить выход метанола, изменяя Т, p и концентрации всех компонентов реакции? Газы считать идеальными.
157. Эквивалентная электропроводность водного раствора сильного электролита при 25 °С равна 109,9 См× см2/моль при концентрации 6,2×10-3 моль/л и 106,1 См×см2/моль при концентрации 1.5×10-2 моль/л. Какова эквивалентная электропроводность раствора при бесконечном разбавлении.
158. Водный раствор, содержащий 0.225 моль/л NaOH, замерзает при минус 0,667оС. Определите кажущуюся степень диссоциации NaOH в этом растворе, если криоскопическая постоянная воды 1,86. Плотность раствора принять равной 1.
159. Осмотическое давление крови составляет 0,811 МПа. Какова должна быть концентрация раствора NaCl, чтобы он был изотоничен с кровью. Примите степень диссоциации NaCl равной 0,950.
160. Рассчитайте активность электролита а и среднюю ионную активность а ± в 0,2 m растворе AlCl3 при 25°С, если g±=0,305.
161. Чему равна моляльность раствора Na3PO4, имеющего такую же ионную силу, как 0,36 моль/кг раствор KCl?
162. Ферментативная цепь дыхания заканчивается цитохромоксидазой, переносящей электроны на активированный кислород. Суммарная реакция может быть представлена в виде:
2cyt c(red) + 1/2O2 + 2H+ ® 2cyt c (ox) + H2O,
163. E ° (25oC, pH = 7) = + 0,562 В. Рассчитайте стандартную энергию Гиббса этой реакции. В каком направлении пойдет реакции при изменении кислотности раствора до: а) pH = 4, б) pH = 9?
164. - 174. Для данной реакции, уравняв материальный баланс, рассчитайте величины энтальпии и энтропии реакции ∆Н0298 и ∆S0298, определите температуру начала реакции (температуру, при которой энергия Гиббса ∆G0298 = 0), сделайте вывод о возможности протекания реакции при стандартных условиях, рассчитайте константу химического равновесия (табл. 14).
165.
Таблица 14.
| № варианта | Уравнение реакции |
| С(Т) +О2→СО2 | |
| СО +О2→СО2 | |
| Fe2O3(T)+CO→ Fe (T)+H2О(T) | |
| FeO(T)+H2→ Fe (T)+H2О(T) | |
| Al2O3+H2→ Al(T)+H2О(T) | |
| СО +H2→CH4+СО2 | |
| СО +H2→CH4+H2О(T) | |
| Fe2O3+CO→ FeO (T)+CО2 | |
| CH4+O2→ CO2+H2О(T) | |
| Al2O3(T)+C(T)→ Al(T)+CО2 | |
| FeO(T)+CO→ Fe (T)+CО2 |
175. Чему равен общий порядок элементарных реакций
а) Cl+H2 ® HCl+H
б) 2NO + Cl2® 2NOCl?
Во сколько раз увеличится скорость этих реакций при увеличении давления в 3 раза?
176. Какой должна быть энергия активации, чтобы скорость реакции увеличилась в 3 раза при возрастании температуры на 10°С а) при 300 К б)1000 К?
177. Для газофазной реакции HJ + CH3J®CH4 + J2 энергия активации 140 кДж/моль. Константа скорости при 227°С равна 3,9×10-3 л/моль×с.
Рассчитайте константу скорости при 310°С. При какой температуре константа скорости будет равна 1,0×10-3 л/моль×с?
178. Для реакции 2 N2O ® 2 N2 + O2 константа скорости при температуре 986 К равна 6,72 л/моль×мин, а при температуре 1165 К–977,0 л/моль×мин.
Найдите энергию активации этой реакции и константу скорости при температуре 1053,0 К.
179. Для реакции CH3COOC2H5 + NaOH ® CH3COONa + C2H5OH константа скорости при температуре 282,6 К равна 2,307 л/моль×мин, а при температуре 318,1 К – 21,65 л/моль×мин.
Найдите энергию активации этой реакции и константу скорости при температуре 343 К.
180. Для реакции C12H22O11 + H2O ® C6H12O6 + C6H12O6 константа скорости при температуре 298,2 К равна 0,762 л/моль×мин, а при температуре 328,1 К – 35,5 л/моль×мин.
Найдите энергию активации этой реакции и константу скорости при температуре 313,2 К.
181. В сосуде имеется 0,025 г радона. Период половины превращения τ 1/2 радона 3,82 дня. Какое количество радона (в масс. долях, %) останется в сосуде через 14 дней?
Ответ: 7, 92 %
182. Имеется 5 мг радия, период половины превращения которого равен 19,7 мин. Какое количество радия (мг) останется через 2,5 ч.?
Ответ: 0,02553 мг.
183. В сосуде имеется 0,017 г Ra. Какое количество радия (в масс. долях, %) останется в сосуде через 2 ч, если период половины превращения его 26,8 мин?
Ответ: 4,49 %
184. –194. Уравняйте материальный баланс в реакции А + В = С + D, запишите выражения закона действующих масс для прямой и обратной реакции. Определите, во сколько раз изменится скорость реакции в следующих случаях:
1) при изменении температуры ∆t и температурном коэффициенте скорости реакции γ; 2) при изменении давления Р или объёма V;
3) при одновременном изменении концентрации СА и СВ.
Предложите способы смещения химического равновесия в данной реакции вправо. Рассчитайте неизвестные равновесные концентрации и константу равновесия по начальным концентрациям СНА, СНВ, СНС, СНD, и равновесной концентрации СPA (индекс 1 относится к начальным условиям, индекс 2 – к конечным) (табл. 15,16).
Таблица 15
| № варианта | А | В | С | D | Концентрация, моль/л | ||||
| СHA | CHB | CHC | CHD | CPA | |||||
| C2H2 | O2 | CO2 | H2O(г) | 2,0 | 3,0 | 1,0 | 1,0 | 1,9 | |
| C2H6 | O2 | CO2 | H2O(г) | 1,0 | 4,0 | 2,0 | 3,0 | 0,8 | |
| H2 | CI2 | HCI | - | 2,0 | 3,0 | 4,0 | - | 1,0 | |
| N2 | O2 | NO | - | 1,0 | 0,5 | 2,0 | - | 0,7 | |
| NO | O2 | NO2 | - | 3,0 | 1,0 | 2,0 | - | 2,5 | |
| CH4 | - | H2 | С2H2 | 2,0 | - | 3,0 | 2,0 | 1,0 | |
| SO2 | O2 | SO3 | - | 4,0 | 3,0 | 3,0 | - | 2,5 | |
| N2 | H2 | NH3 | - | 2,0 | 4,0 | 4,0 | - | 1,4 | |
| CO2 | H2 | CH4 | H2O(г) | 1,0 | 2,0 | 2,0 | 1,0 | 0,6 | |
| NO | CI2 | NOCI | - | 3,0 | 5,0 | 1,0 | - | 2,5 | |
| H2 | O2 | H2O(г) | - | 5,0 | 7,0 | 3,0 | - | 4,0 |
Таблица 16
| № варианта | ∆t = t2-t1, 0С | γ | P2/P1 | V2/V1 | CA2/ СА1 | Св2/Св2 |
| 2,5 | ||||||
| 3,0 | 1/2 | |||||
| 3,5 | 1/3 | |||||
| 4,0 | 1/4 | |||||
| 2,0 | 1/2 | |||||
| 2,5 | 1/3 | |||||
| 3,0 | 1/4 | |||||
| 3,5 | ||||||
| 4,0 | ||||||
| 2,0 | ||||||
| 2,5 | 1/2 | 1/3 |
195. – 205. Рассчитайте, во сколько раз изменится константа скорости химической реакции. 1) при введении в систему катализатора, изменяющего энергию активации от начальной Е1 до Е2 2) при изменении температуры системы от Т1 до Т2, 3) при одновременном введении в систему катализатора и изменении температуры (табл. 17). Укажите, в каких областях сельскохозяйственного производства стремятся изменить скорость химических реакций, и какими способами это делают.
Таблица 17
| № варианта | Е1, кДж/моль | Е2 кДж/моль | Т1, К | Т2, К |
| 17,3 | 8,1 | |||
| 58,1 | 43,2 | |||
| 14,7 | 9,4 | |||
| 74,8 | 65,5 | |||
| 49,6 | 35,4 | |||
| 20,7 | 13,2 | |||
| 40,9 | 29,4 | |||
| 34,4 | 10,2 | |||
| 41,4 | 20,9 | |||
| 36,7 | 19,4 |
206. Охарактеризуйте поверхностные явления и адсорбцию. От каких факторов зависят поверхностные явления?
207. Охарактеризуйте понятия: физическая адсорбция и хемосорбция.
208. Опишите адсорбцию на границе жидкость – газ.
209. Что такое поверхностно-активные вещества, какова их ориентация в поверхностном слое? Охарактеризуйте механизм их действия.
210. Опишите адсорбцию на границе твердое тело – жидкость, твердое тело – газ. Изотерма адсорбции Фрейндлиха. Приведите ее недостатки.
211. Опишите адсорбцию на границе твердое тело – жидкость, твердое тело – газ. Изотерма адсорбции Ленгмюра. Определение констант уравнения Ленгмюра.
212. Изотермы адсорбции Гиббса, Фрейндлиха, Ленгмюра. Их сравнительный анализ.
213. Что такое поверхностное натяжение и как оно определяется?
214. Что такое обменная адсорбция? Каким уравнением она описывается?
215. Что такое смачивание? Какие поверхности называются гидрофильными и гидрофобными?
216. Какие виды адсорбции наблюдаются в почвах? Адсорбция и биологические процессы.
217. Где в общественном питании используется ионообменная адсорбция?
218. Какие системы называются коллоидами? Чем можно объяснить неустойчивость коллоидно-дисперсных систем? Какова роль стабилизатора?
219. В чем сходство растворов высокомолекулярных соединений и коллоидов? Приведите классификацию дисперсных систем по агрегатному состоянию фазы и дисперсной среды.
220. Что такое гидрофильные и гидрофобные золи? Представьте строение мицеллы лифобного золя. Каковы причины существования двойного электрического слоя?
221. Условия получения коллоидного состояния. Сущность дисперсионных методов получения коллоидно-дисперсных систем.
222. Условия получения коллоидного состояния. Сущность конденсационных методов получения коллоидно-дисперсного состояния.
223. Опишите методы отчистки коллоидных систем. На каких свойствах коллоидных систем они основаны?
224. Какие оптические явления наблюдаются в коллоидных системах? Закон Рэлея.
225. Охарактеризуйте оптическое давление в коллоидно-дисперсных системах. Мембранное равновесие Дониана и его значение в живой природе.
226. Каковы электрокинетические свойства коллоидов? Понятие об электросмосе, электрофорезе, потенциалах оседания и протекания.
227. Охарактеризуйте Двойной электрический слой в дисперсной системе по Гельмгольцу и Гуи-Чапману. Укажите условия его образования для дисперсных систем.
228. Какие скачки потенциалов выделяют в мицелле? В каком соотношении друг с другом они находятся?
229. Охарактеризуйте явление седиментации. Что такое эффект протекания, эффект седиментации?
230. Что называется коагуляцией, порогом коагуляции и коагулирующей способностью? Каковы факторы коагуляции?
231. Что такое пептизация коллоидов? Чем она вызывается и с чем связана?
Пептизация почвенных коллоидов.
232. Что такое старение коллоидов? Какие приемы используют для стабилизации коллоидных систем?
233. Какие вещества относятся к высокомолекулярным соединениям? Каковы причины устойчивости растворов ВМС?
234. В чем сущность набухания (органического и неорганического). Связанная вода и её свойства.
235. Что такое коацервация, чем она вызывается, каково значение коацервации в биологических процессах?
236. Что такое студень, гель? Опишите особенности физико-химических свойств студней и гелей. Как протекают химические реакции в гелях?
237. Что представляют собой мембраны живых организмов с точки зрения коллоидной химии? Какова их биологическая роль?
238. Что такое синерезис? Каково его биологическое значение?
239. Охарактеризуйте явление тиксотропии и приведите примеры тиксотропных превращений в технологии пищевых производств.
240. Какие дисперсные системы называются пенами? От чего зависит устойчивость пены? Использование свойств пенообразования в кондитерском и пищевом производствах.
241. Что представляют собой эмульсии? Их классификация. Какие методы стабилизации эмульсий известны.
242. Представьте строение мицеллы золя Fe(OH)3, полученного гидролизом FeСl3, укажите знак заряда иона коагулятора. Рассчитайте порог коагуляции, если на 10 мл золя потребовалось 6,25 мл 0,01н. раствора сульфата алюминия.
243. Золь AgJ получен при добавлении 8 мл водного раствора KJ концентрацией 0,05 моль/л к 10 мл водного раствора AgNO3 концентрацией 0.02 моль/л. Напишите формулу мицеллы образовавшегося золя. Как заряжена частица золя? Каким методом можно определить этот заряд?
244. Золь гидроксида железа (III) получен при добавлении к 85 мл кипящей дистиллированной воды 15 мл 2%-ного раствора хлорида железа (III). Напишите формулу мицелл золя Fe(OH)3, учитывая, что при образовании частиц гидроксида железа (III) в растворе присутствуют следующие ионы Fe3+, Cl-. Как заряжены частицы золя?
245. Порог коагуляции отрицательно заряженного гидрозоля As2S3 под действием KCl равен 4,9 ×10-2 моль/л. С помощью правил Шульце-Гарди и Дерягина-Ландау для этого золя рассчитайте пороги коагуляции, вызываемой следующими электролитами: K2SO4, MgCl2, MgSO4, AlCl3, Al2(SO4)3.
246. Порог коагуляции положительно заряженного гидрозоля Fe(OH)3 под действием NaCl равен 9,25 ммоль/л. С помощью правил Шульце-Гарди и Дерягина-Ландау для этого золя рассчитайте пороги коагуляции, вызываемой следующими электролитами: KNO3, BaCl2, K2SO4, MgSO4, K2Cr2O7.
247. Какое количество электролита K2Cr2O7 нужно добавить к 1,0 л золя Al2O3, чтобы вызвать его коагуляцию? Концентрация электролита 0,01 моль/л, порог коагуляции g = 0,63×10-3 моль/л.
248. Во сколько раз уменьшится порог коагуляции золя As2S3, если для коагуляции вместо 0,5 моль/л NaCl (его требуется 1,2 мл на 10 мл золя) использовать 0.036 моль/л MgCl2 (0,4 мл на 10 мл золя) и 0.01 моль/л AlCl3 (0,1 мл на 10 мл золя)? Полученные значения g сопоставить с зависимостью порога коагуляции от валентности ионов, установленной Б.В. Дерягиным.
249. Как изменится величина порога коагуляции, если для коагуляции 10 мл золя AgJ вместо 1,5 мл KNO3 концентрации 1 моль/л взять 0,5 мл Ca(NO3)2 концентрации 0,1 моль/л или 0,2 мл Al(NO3)3 концентрации 0,01 моль/л? Полученные значения порога коагуляции сопоставить с зависимостью от валентности ионов, установленной Б.В. Дерягиным.
250. Вычислить скорость электрофореза коллоидных частиц берлинской лазури в воде, если электрокинетический потенциал составляет V = 0,058 В, градиент напряжения внешнего поля Н = 5×10-2 в/м, вязкость среды h = 10-3н×сек/м2, диэлектрическая проницаемость e=81, электрическая константа eо=8,85×10-12ф/м.
7. Материалы для контроля знаний
 2015-02-04
2015-02-04 1604
1604








