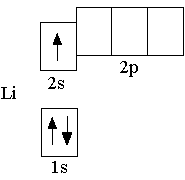
У следующего за гелием элемента лития (Z = +3) третий электрон уже не может разместиться на первом энергетическом уровне, т.к. как на одной орбитали не может находиться более двух электронов. Поэтому третий электрон должен располагаться на втором энергетическом уровне n = 2.
 Сначала заполняется более низкая по энергии орбиталь. Поэтому третий электрон в атоме лития располагается на
Сначала заполняется более низкая по энергии орбиталь. Поэтому третий электрон в атоме лития располагается на
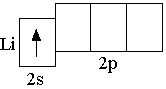
2s-орбитали, так как 2s-орбиталь имеет более низкую энергию, чем
2p-орбиталь. Полная электронная формула атома лития: 1s22s1. Очень часто, записывая электронную формулу и электронно-графическую схему, указывают только орбитали внешнего энергетического уровня. Такие электронные формулы и электронно-графические схемы называются сокращёнными. Сокращённая электронная формула атома лития 2s1, сокращённая электронно-графическая схема:
Электронную конфигурацию атома следующего за литием элемента бериллия (Z = +4) отражает сокращённая электронная формула 2s2. Сокращённая электронно графическая схема атома Be:
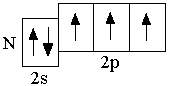 Элементы, в атомах которых электронами заполняются s-орбитали, называются s-элементами (т.е. H, He, Li, Be – это s-элементы)
Элементы, в атомах которых электронами заполняются s-орбитали, называются s-элементами (т.е. H, He, Li, Be – это s-элементы) 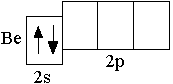 . Следующие за бериллием элементы второго периода – бор, углерод, азот, кислород, фтор, неон – являются p-элементами: у них происходит заполнение электронами
. Следующие за бериллием элементы второго периода – бор, углерод, азот, кислород, фтор, неон – являются p-элементами: у них происходит заполнение электронами
p-орбиталей. Ниже представлены сокращённые электронно-графические схемы и сокращённые электронные формулы этих элементов.
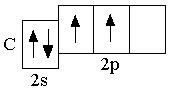
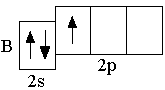
B 2s22p1 C 2s22p2 N 2s22p3
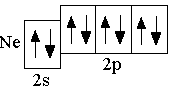
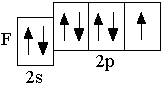
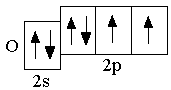
O 2s22p4 F 2s22p5 Ne 2s22p6
При записи сокращённых электронных формул важно понимать, что число электронов на внешнем энергетическом уровне атомов s- и p-элементов равно номеру группы.
 2015-02-04
2015-02-04 1492
1492








