2.1. Концентрация молекул газа (число молекул в единице объема)
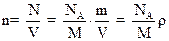 ,
,
где N - число молекул; V – объем; m – масса; М- масса моля; NA - постоянная Авогадро; ρ - плотность газа.
2.2. Количество вещества однородного газа
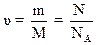 ,
,
где m - масса газа; М – молярная масса газа; N - число молекул газа; NA - постоянная Авогадро; NA = 6,023·1023 моль-1.
2.3. Уравнение Менделеева-Клапейрона (уравнение состояния идеального газа)
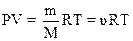 ,
,
где Р – давление; V – объем; R - молярная газовая постоянная, численно равная 8,31 Дж/моль·К; Т- абсолютная температура в кельвинах (Т = t + 273, где t - температура в градусах Цельсия).
2.4. Плотность идеального газа
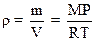 .
.
2.5. Объединенный газовый закон (m = const)
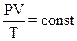 или
или 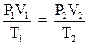 ,
,
где Р1, V1, T1 - давление, объем, температура газа в начальном состоянии; Р2, V2, T2 - те же величины в конечном состоянии.
2.6. Основное уравнение кинетической теории газов
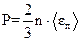 ,
,
где <εп>- средняя кинетическая энергия поступательного движения молекулы; n - концентрация молекул (число молекул в единице объёма).
2.7. Средняя полная кинетическая энергия молекулы:
|
|
|
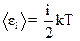 ,
,
где i - число степеней свободы; k - постоянная Больцмана (k =R/NA).
2.8. Молярные теплоемкости газа при постоянном объёме (CV) и при постоянном давлении (СP)
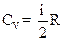 ;
; 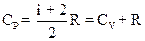 .
.
2.9. Внутренняя энергия идеального газа
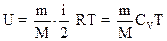 .
.
2.10. Первое начало термодинамики
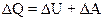 ,
,
где ∆Q - теплота, сообщенная газу; ∆U - изменение внутренней энергии газа; ∆А - работа, совершенная газом против внешних сил.
2.10. Работа расширения газа:
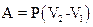 - при изобарном процессе;
- при изобарном процессе;
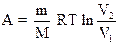 - при изотермическом процессе;
- при изотермическом процессе;
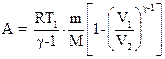 при адиабатном процессе.
при адиабатном процессе.
2.11. Уравнение Пуассона (уравнение адиабаты)
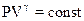 ,
,
где 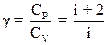 .
.
2.12. Термический коэффициент полезного действия цикла Карно
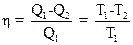 ,
,
где Q1 - теплота, полученная рабочим телом от теплоотдатчика; Q2 – теплота, переданная рабочим телом теплоприемнику; T1 и T2 -термодинамические температуры теплоотдатчика и теплоприемника соответственно.
 2015-02-15
2015-02-15 397
397








