Создание процесса каталитического крекинга было вызвано необходимостью смягчить условия крекинга нефтяных продуктов (понизить температуру
и давление), повысить выход бензина и улучшить его качество. Наиболее активным катализатором крекинга углеводородов является хлорид алюминия. Впервые крекинг в присутствии AlВr3 и А1С13 был проведен в России Густавсоном. Под действием хлорида алюминия крекинг, например, парафина начинается при 100 °С, а при 200 °С он протекает с высокой скоростью. Однако в процессе использовании этого катализатора были выявлены следующие недостатки: повышение расхода хлорида алюминия и невозможность его регенерации, а также выделение при его разложении под действием влаги хлорида водорода, сильно коррозирующего аппаратуру.
В настоящее время в качестве катализаторов крекинга широко используются аморфные и кристаллические алюмосиликатные катализаторы (ААК), которые менее активны, чем хлорид алюминия, но лишены всех его недостатков. Эти катализаторы обладают высокой механической прочностью, высокой химической и термической стабильностью, не вступают в необратимое химическое взаимодействие с сырьем, легко реактивируются выжигом углеродистых отложений (кокса). Крекинг в присутствии алюмосиликатных катализаторов проходит в паровой фазе при 400…500 °С и давлении, близком к атмосферному. Сырьем служат вакуумные газойли с концом кипения 500 °С и выше, к которым иногда добавляют деасфалътизаты нефтяных остатков (около 20 %).
Химический состав алюмосиликатного катализатора иногда рассматривают как смесь оксида алюминия и оксида кремния, находящихся в химическом соединении, и записывают химическую формулу алюмосиликатного катализатора следующим образом: n Al2O3× m SiO2× х Н2O. Необходимо отметить, что ни оксид алюминия, ни оксид кремния, взятые в отдельности, не являются катализаторами крекинга. Их механические смеси также неактивны. Однако, если добавить к гелю кремниевой кислоты даже небольшое количество геля гидрата оксида алюминия, при прокаливании такой смеси получается активный катализатор крекинга углеводородов.
В настоящее время в нефтеперерабатывающей промышленности широко применяются кристаллические алюмосиликатные цеолитсодержащие катализаторы крекинга. Эти катализаторы содержат до 20 % цеолитов на аморфной алюмосиликатной матрице. Цеолитсодержащие катализаторы крекинга значительно активнее аморфных (выход бензина выше на 30 – 50 %). В присутствии цеолитсодержащих катализаторов процесс превращения углеводородов идет глубоко. Состав продуктов крекинга с использованием ААК и цеолитов существенно различается. Бензин, полученный при крекинге на ААК, содержит 30 % ароматических углеводородов, 42 % нафтенов, 12 % олефинов, 12 % алканов; а бензин, полученный из того же сырья на цеолите, содержит 50 % ароматических углеводородов, 22 % нафтенов, 5 % олефинов и 25 % алканов. В газе крекинга на цеолитсодержащем катализаторе больше изобутана и меньше бутенов, чем в газе крекинга на аморфном алюмосиликатом катализаторе.
На поверхности алюмосиликатных катализаторов имеются два типа каталитических центров: протонные и апротонные:
протонные центры апротонные центры
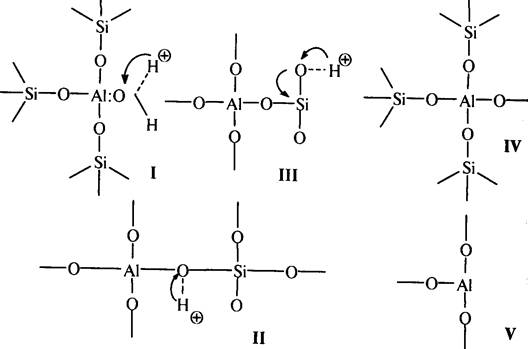
Наличие в алюмосиликатных катализаторах протонных и апротонных кис-лотных центров доказано с помощью ИК-спектроскопии.
С участием протонных центров алюмосиликатных катализаторов катализ осуществляется подвижными протонами. Это либо протоны воды, хемисорбированной координационно ненасыщенным атомом алюминия (структура I), либо протоны гидроксильных групп, адсорбированных атомом алюминия (структура II) или свободных (структура III). В этих структурах протон приобретает подвижность вследствие сильной поляризации связи О–Н за счет электроноакцепторных свойств координационно ненасыщенного атома алюминия.
На поверхности цеолитов поливалентных металлов также находятся как апротонные (координационно ненасыщенные атомы алюминия), так и протонные активные центры. Кроме протонных центров, в цеолитах поливалентных металлов имеются протонные центры, обусловленные протонизацией молекул воды, адсорбированных катионами металла:
Ме+n ×Н2O D Ме+nОН-......Н+
В апротонных центрах носителями каталитической активности являются координационно ненасыщенные атомы алюминия с координационными числами 5, 4, 3. Вероятность существования атомов алюминия с координационным числом 3 мала (структура V) вследствие очень высокой активности таких атомов; наиболее вероятно наличие атома алюминия с координационным числом 4 в алюмокислородном тетраэдре А1O4 (структура IV).
Механизм взаимодействия реагирующих молекул углеводородов с активными центрами катализатора можно представить следующим образом.
Протоны, входящие в состав протонных кислотных центров, взаимодействуют с молекулами углеводородов, превращая их в карбокатионы, которые подвергаются дальнейшим превращениям. В соответствии с теорией катализа полиэдрами[1], выдвинутой И. М. Колесниковым и Г. М. Панченковым, координационно ненасыщенный атом алюминия в апротонном центре является акцептором электронов. В процессе хемосорбции, предшествующей химической реакции, электроны реакционноспособных центров молекул углеводорода переходят на вакантные орбитали координационно ненасыщенных атомов алюминия, и образующиеся при этом катион-радикалы углеводородов подвергаются дальнейшим превращениям.
Как и при термическом, при каталитическом крекинге алканов происходит распад молекул с образованием молекулы алкана и молекулы алкена с меньшей молекулярной массой:
R–CH2–CH2–CH2–CH3 ® R–СН3 + СН2=СН–СН3
Протекает также дегидрирование с образованием олефинов. Каталитический крекинг углеводородов включает стадии инициирования, роста цепи и обрыва цепи.
По сравнению с термическим каталитический крекинг имеет ряд особенностей.
1. Скорость каталитического крекинга алканов в 40 – 60 раз больше скорости их термического крекинга при одной и той же температуре (500 °С).
2. Жидкие продукты каталитического крекинга алканов имеют преимущественно изостроение. Следовательно, при каталитическом крекинге протекает интенсивно изомеризация.
3. Газообразные продукты каталитического крекинга состоят из углеводородов состава С3 и С4 (пропилен, пропан, изобутилен, изобутан, бутены), в то время как в газообразных продуктах термического крекинга преобладают углеводороды состава С1 и С2 (метан, этан, этилен).
4. Скорость каталитического крекинга чистых алканов резко возрастает
в присутствии следов олефинов.
5. Изоалканы подвергаются крекингу с большей скоростью, чем алканы
с прямой цепью.
Устойчивость углеводородов к химическим превращениям возрастает при термическом и каталитическом крекинге в следующих рядах.
Термический крекинг: парафины < олефины < нафтены < алкиларены <
< арены, не имеющие заместителей.
Каталитический крекинг: олефины < алкиларены < нафтены < парафины <
< арены, не имеющие заместителей.
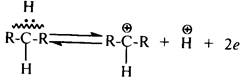
Особенности каталитического крекинга, а также кислотный характер катализаторов крекинга привели к появлению гипотезы об ионном механизме каталитического крекинга углеводородов через стадию образования карбокатионов. Эта гипотеза была выдвинута американскими учеными Хансфэрдом, Гринсфельдером и Томасом. Карбокатион – это положительно заряженный углеводородный ион, который можно рассматривать как продукт отщепления от молекулы алкана протона и пары электронов:
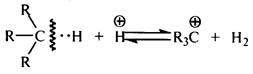
Для образования карбокатиона из молекулы алкана необходимо гетеролитическое расщепление связи С–Н, которое может проходить под действием как апротонного, так и протонного кислотного центра:
Карбокатионы могут быть первичными, вторичными и третичными:
 СН3–СН2–СН2–+СН2 СН3–+СН–СН2–СН3 СН3–+С–СН3
СН3–СН2–СН2–+СН2 СН3–+СН–СН2–СН3 СН3–+С–СН3
СН3
первичный вторичный третичный
Третичные карбокатионы более устойчивы, чем вторичные и первичные, так как положительный заряд на третичном атоме углерода частично компенсирован смещением электронов от трех алкильных групп.
Образование карбокатиона из олефинов на поверхности алюмосиликатного катализатора происходит при взаимодействии протона каталитического центра с p-электронами двойной связи:
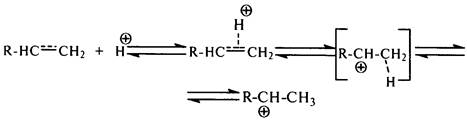
Образовавшийся карбокатион либо взаимодействует с молекулами других углеводородов, либо подвергается расщеплению, что приводит к продолжению реакционной цепи.
Карбокатионы могут подвергаться различным превращениям, что способствует развитию цепного процесса каталитического крекинга. Все превращения карбокатионов обусловлены их нестабильностью и стремлением стабилизоваться. Карбокатионы могут претерпевать следующие превращения.
Изомеризация. Первичные карбокатионы стремятся превратиться во вторичные за счет гидридного переноса (2,1-сдвиг гидрид-иона Н–)
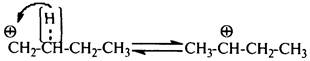 ,
,
вторичные – в третичные за счет алкильного переноса. При алкильном переносе происходит переход алкиланиона (метил –:СН3, этил –:С2Н5), с разрывом связи в b-положении по отношению к атому углерода с положительным зарядом:
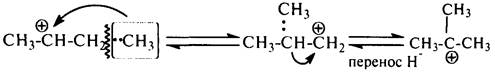
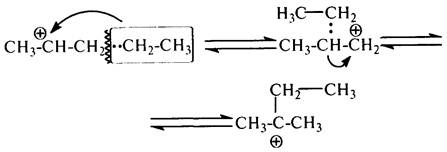
Другие алкильные группы (например, пропил, бутил) в условиях каталитического крекинга легче отщепляются в виде карбокатионов, чем участвуют
в алкильном переносе.
Расщепление. Карбокатионы стремятся стабилизироваться путем разрыва b-связи С–С с образованием алкена и нового карбокатиона:
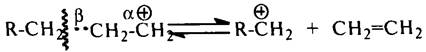
Разрыв b-связи С–С (а не a- или g-связи) объясняется тем, что под действием положительно заряженного атома углерода происходит более сильное смещение электронной плотности (поляризация) b-связей С–С по сравнению с a- и g-связями. Разрыв a- и g-связей энергетически невыгоден, так как приводит к образованию двух нестабильных частиц. Расщепление карбокатиона по b-связи протекает тем легче, чем больше молекулярная масса образующегося при распаде нового иона.
Взаимодействие карбокатионов с углеводородами. Сталкиваясь с молекулой алкана, карбокатион отрывает от нее гидрид-ион (Н–):
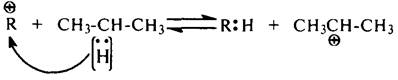
В эту реакцию вступают главным образом низшие карбокатионы: +СН3, +С2Н5, +С3Н7. Карбокатионы с большей молекулярной массой могут также
отрывать гидрид-ионы от молекул углеводородов, однако они легче расщепляются.
Сталкиваясь с молекулами олефинов, низшие карбокатионы так же, как и протон, присоединяются к двойной связи
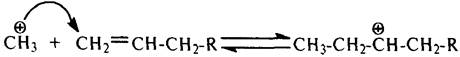 ,
,
либо отщепляют гидрид-ион с образованием стабильных аллильных карбокатионов:
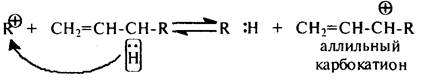
Аллильный карбокатион устойчив, обладает пониженной реакционной способностью вследствие того, что положительный заряд делокализован между тремя атомами углерода:
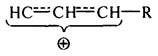
В присутствии катализаторов алкены подвергаются крекингу значительно легче, чем алканы (при термическом крекинге труднее). Это объясняется большей способностью алкенов хемосорбироваться на активных центрах катализатора из-за наличия подвижных p-электронов. В условиях каталитического крекинга алкены изомеризуются, образуя циклические структуры. Скорость каталитического крекинга алкенов на 2-3 порядка выше скорости их термического крекинга.
 В процессе крекингаалкенов происходит расщепление по связи С–С в b-положении по отношению к двойной связи. При этом из одной молекулы алкена образуются в простейшем случае две молекулы алкенов:
В процессе крекингаалкенов происходит расщепление по связи С–С в b-положении по отношению к двойной связи. При этом из одной молекулы алкена образуются в простейшем случае две молекулы алкенов:
R-CH2-CH2-CH2 - СH2-CH=CH2 D R-CH2-CH=CH2 + СН3-СН=СН2
Каталитический крекинг нафтенов протекает в 1 000 раз быстрее, чем термический. Нафтены подвергаются расщеплению по С–С-связям (расщепляяется кольцо или боковая цепь), а также реакциям изомеризации и дегидрогенизации.
Расщепление нафтеновможно представить в виде упрощенной схемы
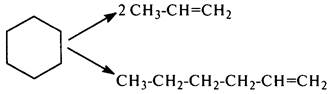
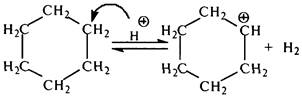
На первой стадии расщепления нафтенов образуется циклогексильный карбокатион, который затем расщепляется по b-связи. Образующийся при этом ненасыщенный первичный карбокатион изомеризуется во вторичный, который далее расщепляется:
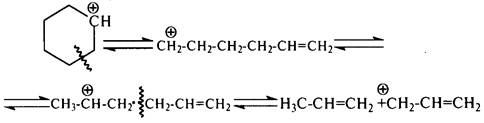
Затем аллил-карбокатион +СН2–СН=СН2 взаимодействует с циклогексаном с образованием циклогексильного крбокатиона и пропена по схеме:
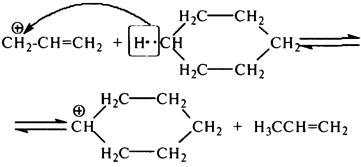
Дегидрирование нафтенов приводит к образованию аренов:
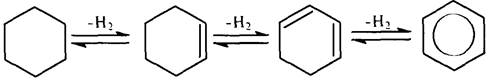
Механизм дегидрирования нафтенов можно представить следующим образом: под действием протонного кислотного центра катализатора происходит образование карбокатиона и расщепление b-связи С–Н:
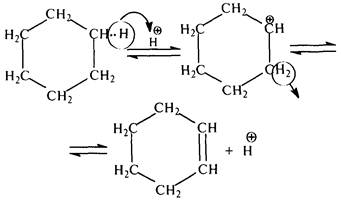
В дальнейшем от аллильного атома углерода молекулы циклогексена под действием карбокатиона R+ может отщепиться гидрид-ион (Н–):
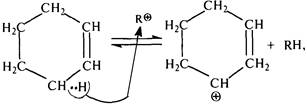
затем протон (Н+):
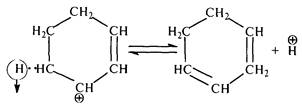
циклогексадиен-1,3
По аналогичной схеме циклогексадиен затем превращается в бензол.
Изомеризация циклогексановых углеводородов приводит к сужению кольца.
Ароматические углеводороды, не содержащие заместителей в кольце (бензол, нафталин), в условиях каталитического крекинга практически не подвергаются превращениям; крекинг толуола в этих условиях проходит незначительно. Высшие алкилбензолы легко подвергаются крекингу, причем скорость их превращения выше скорости термического крекинга. В условиях каталитического крекинга (в отличие от термического крекинга) расщепляется не b-,
а a-связь С–С боковой цепи алкилбензола:
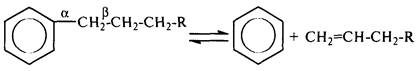
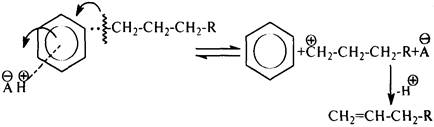
Это объясняется тем, что в процессе крекинга образуется p-комплекс между активным центром катализатора (АН) и p-электронами бензольного ядра. Образование p-комплекса приводит к поляризации a-связи С–С, облегчает ее гетеролитический разрыв:
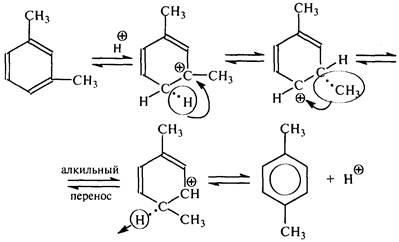
Кроме отщепления боковой цепи происходит перемещение боковых цепей по кольцу (изомеризация). Например, изомеризация м -ксилола в п -ксилол:
В табл. 1.1 приведены превращения углеводородов при термическом и каталитическом крекинге.
Таблица 1.1
 2015-03-22
2015-03-22 4500
4500
