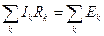 . (12.29)
. (12.29)
При составлении уравнений по второму закону Кирхгофа необходимо выбрать направление обхода контуров (по часовой стрелке или против нее). Все токи на участках цепи и ЭДС, совпадающие с направлением обхода, считаются положительными. Уравнения (12.29) составляются для независимых контуров, т.е. таких контуров, для которых каждый новый контур содержит хотя бы одну новую ветвь (участок цепи между двумя узлами), не входящую в уже рассмотренные контуры. Обозначим число неизвестных токов схемы через m. Тогда число уравнений по второму закону Кирхгофа равно m−(y−1).
Составим уравнения по второму закону Кирхгофа для схемы на рис. 12.7. для контуров I, II и III, полагая их обход по часовой стрелке:
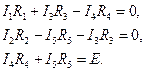
Система уравнений по первому и второму законам Кирхгофа для схемы на рис.12.7 содержит шесть уравнений относительно неизвестных токов I, I1, I2, I3, I4, I5. Эта система позволяет полностью решить задачу расчета искомых токов.
12d:\Program Files\Physicon\Open Physics 2.5 part 1\content\chapter1\section\paragraph2\theory.htmld:\Program Files\Physicon\Open Physics 2.5 part 1\design\images\ring_h.gif.7. Электрический ток в газах
Газы при температурах и давлениях, близких к атмосферному, являются хорошими изоляторами. Это объясняется тем, что газы при обычных условиях состоят из нейтральных атомов и молекул и не содержат свободных зарядов (электронов и ионов). Газ становится проводником электричества, когда некоторая часть его молекул ионизуется, т. е. произойдет расщепление нейтральных атомов и молекул на ионы и свободные электроны. Для этого газ надо подвергнуть действию какого-либо ионизатора.
При ионизации газов под действием какого-либо ионизатора происходит вырывание из электронной оболочки атома или молекулы одного или нескольких электронов, что приводит к образованию свободных электронов и положительных ионов. Электроны могут присоединяться к нейтральным молекулам и атомам, превращая их в отрицательные ионы. Следовательно, в ионизованном газе имеются положительные и отрицательные ионы и свободные электроны. Прохождение электрического тока через газы называется газовым разрядом.
Ионизация газов может происходить под действием различных ионизаторов: сильный нагрев (столкновения быстрых молекул становятся настолько сильными, что они разбиваются на ионы), короткое электромагнитное излучение (ультрафиолетовое, рентгеновское и 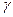 - излучения), корпускулярное излучение (потоки электронов, протонов,
- излучения), корпускулярное излучение (потоки электронов, протонов, 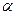 -частиц) и т. д. Для того чтобы выбить из молекулы (атома) один электрон, необходимо затратить определенную энергию, называемую энергией ионизации, значения которой для атомов различных веществ лежат в пределах 4 - 25 эВ.
-частиц) и т. д. Для того чтобы выбить из молекулы (атома) один электрон, необходимо затратить определенную энергию, называемую энергией ионизации, значения которой для атомов различных веществ лежат в пределах 4 - 25 эВ.
Одновременно с процессом ионизации газа всегда идет и обратный процесс - процесс рекомбинации: положительные и отрицательные ионы, положительные ионы и электроны, встречаясь, воссоединяются между собой с образованием нейтральных атомов и молекул. Чем больше ионов возникает под действием ионизатора, тем интенсивнее идет и процесс рекомбинации.
Строго говоря, электропроводность газа нулю не равна никогда, так как в нем всегда имеются свободные заряды, образующиеся в результате действия на газы излучения радиоактивных веществ, имеющихся на поверхности Земли, а также космического излучения. Эта незначительная электропроводность воздуха (интенсивность ионизации под действием указанных факторов невелика) служит причиной утечки зарядов наэлектризованных тел даже при хорошей их изоляции.
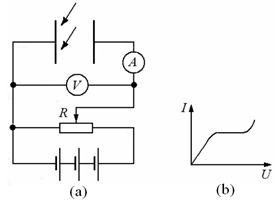
Рассмотрим цепь, содержащую газовый промежуток (рис. 12.9 а), подвергающийся непрерывному, постоянному по интенсивности воздействию ионизатора. В результате ионизации газ приобретает некоторую электропроводность и в цепи потечет ток 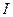 , зависимость которого от приложенного напряжения
, зависимость которого от приложенного напряжения 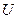 дана на рис. 12.9 б.
дана на рис. 12.9 б.
|
| Рис. 12.9 |
На начальном участке кривой 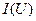 ток возрастает пропорционально напряжению, т. е. линейно. При дальнейшем увеличении напряжения рост тока замедляется и, наконец, прекращается совсем (горизонтальный участок). Этому участку соответствует ток насыщения
ток возрастает пропорционально напряжению, т. е. линейно. При дальнейшем увеличении напряжения рост тока замедляется и, наконец, прекращается совсем (горизонтальный участок). Этому участку соответствует ток насыщения 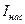 , когда все ионы и электроны, создаваемые внешним ионизатором за единицу времени, за это же время достигают электродов. При дальнейшем увеличении напряжения ток снова резко возрастает, что объясняется возникновением самостоятельного разряда за счет ударной ионизации.
, когда все ионы и электроны, создаваемые внешним ионизатором за единицу времени, за это же время достигают электродов. При дальнейшем увеличении напряжения ток снова резко возрастает, что объясняется возникновением самостоятельного разряда за счет ударной ионизации.
12d:\Program Files\Physicon\Open Physics 2.5 part 1\content\chapter1\section\paragraph2\theory.htmld:\Program Files\Physicon\Open Physics 2.5 part 1\design\images\ring_h.gif.8. Электрический ток в жидкостях
Электролитами принято называть жидкие проводящие среды, в которых протекание электрического тока сопровождается переносом вещества. Носителями свободных зарядов в электролитах являются положительно и отрицательно заряженные ионы. К электролитам относятся многие соединения металлов с металлоидами в расплавленном состоянии, а также некоторые твердые вещества. Однако основными представителями электролитов, широко используемыми в технике, являются водные растворы неорганических кислот, солей и оснований.
Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза.
Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией.
Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора:
CuCl2 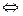 Cu++ + 2Cl–.
Cu++ + 2Cl–.
При подключении электродов к источнику тока ионы под действием электрического поля начинают упорядоченное движение: положительные ионы меди движутся к катоду, а отрицательно заряженные ионы хлора – к аноду (рис. 12.10).
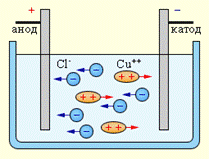
|
| Рис. 12.10 |
Достигнув катода, ионы меди нейтрализуются избыточными электронами катода и превращаются в нейтральные атомы, оседающие на катоде. Ионы хлора, достигнув анода, отдают по одному электрону. После этого нейтральные атомы хлора соединяются попарно и образуют молекулы хлора 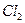 . Хлор выделяется на аноде в виде пузырьков.
. Хлор выделяется на аноде в виде пузырьков.
Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Первый закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе:
масса m вещества, выделившегося на электроде, прямо пропорциональна заряду q, прошедшему через электролит:
m=kq=kIt, (12.30)
где k - электрохимический эквивалент вещества:
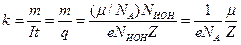 .
.
Здесь μ - молярная масса вещества, NA - число Авогадро, 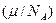 - масса одного иона,
- масса одного иона, 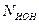 - число выделившихся ионов,
- число выделившихся ионов, 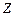 - валентность вещества.
- валентность вещества.
Валентность –этоспособность атома химического элемента образовывать химические связи с другими атомами. Она равна количеству электронов на внешней оболочке атома, способных объединяться с электронами других атомов.
Второй закон Фарадея: электрохимический эквивалент вещества k пропорционален химическому эквиваленту:
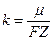 , (12.31)
, (12.31)
F=eNA = 9,65∙104 Кл/моль(12.32)
– постоянная Фарадея.
Удельная проводимость  ионизированной трубки с заряженными ионами
ионизированной трубки с заряженными ионами
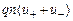 , (12.33)
, (12.33)
где 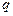 - заряд иона,
- заряд иона, 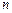 - концентрация ионов в единице объема,
- концентрация ионов в единице объема, 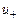 и
и 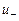 - подвижности положительных и отрицательных ионов.
- подвижности положительных и отрицательных ионов.
 2015-03-27
2015-03-27 616
616








