Переходное состояние системы отвечает образованию так называемого активированного комплекса А2 В2. В этом комплексе происходит перераспределение электронной плотности между атомами: связи А-В начинают образовываться одновременно с разрывом связей А-А и В-В. В активированном комплексе как бы объединены «полуразрушенные» молекулы А2 и В2 и полуобразовавшиеся молекулы АВ. Активированный комплекс существует очень короткое время (порядка 10-13сек).
Его распад приводит к образованию молекул АВ либо А2 и В2 Образование активированного комплекса требует затраты энергии. Вероятность того, что при столкновении 2-х молекул образуется активированный комплекс и произойдет реакция, зависит от энергии сталкивающихся частиц. Реагируют только те из молекул, энергия которых для этого достаточна. Такие молекулы называются активными. Необходимую энергию для перехода веществ в состояние активированного комплекса называют энергией активации (Еа).
Если при распаде активированного комплекса выделяется больше энергии, чем это необходимо для активации частиц, то реакция экзотермическая.
Видно, что разность энергий активации прямой и обратной реакций равна тепловому эффекту. D Н = 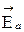 –
– 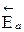 ,
,
когда D Н < О – экзотермический процесс, т.е. 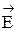 <
< 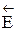 ,
,
D Н > О - эндотермический процесс, т.е. 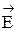 >
> 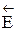 ,
,
для протекания эндотермических реакций требуется подвод энергии извне.
Скорость реакции непосредственно зависит от значения энергии активации, если она мала, то за определенное время протекания реакции энергетический барьер преодолеет большое число частиц и скорость будет высокой, но если энергия активации велика, то реакция идет медленно.
Шведский ученый Аррениус предложил уравнение, выражающее более точно зависимость скорости реакции от температуры:
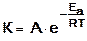 ,
,
где К – константа скорости реакции;
А – предэкспоненциальный множитель, зависящий от числа столкновений молекул за единицу времени;
е - основание натуральных логарифмов (е = 2,72);
Еа – энергия активации;
R - универсальная газовая постоянная;
Т - абсолютная температура.
Из уравнения видно, что чем больше энергия активации, тем меньше константа скорости реакции, т.е. тем меньше скорость реакции.
В логарифмической форме
ln k = ln A – Eа/RT
Если известны константы скорости kT1 и kT2 при двух температурах Т1 и Т2 можно найти значение Еа из уравнения Аррениуса в логарифмической форме:
ln kT1 = lnA – Eа/RT1 (1)
ln kT2 = lnA - Eа/RT2 (2)
Из уравнения 2 вычитаем уравнение 1:
ln kT2 – ln kT1 = -Eа/RT2 + Eа/RT1
ln kT2/kT1 = Eа/R(1/T1 - 1/T2)
Из уравнения Аррениуса видно, что поскольку Т входит в показатель степени, скорость химической реакции очень чувствительна к изменению температуры. Например, при повышении температуры на 100оС скорость реакции
H2(г) + I2(г) = 2HI (г)
возрастает примерно в 1000 раз.
Т, К 556 575 629 666 700 781 K 4,45 ×10-5 1,37× 10-4 2,52 ×10-3 1,41× 10-2 6,43 × 10-2 1,34
 2015-03-08
2015-03-08 640
640








