Инициация репликации ДНК эукариот начинается с образования комплекса ориджина репликации и белка-инициатора репликации. Этот комплекс называется пострепликативным (роst.-RС). Он служит платформой для сборки структур более высокого порядка, которые переводят хроматин в состояние, компетентное для репликации. Последовательные стадии образования комплексов инициации репликации показаны на рис….
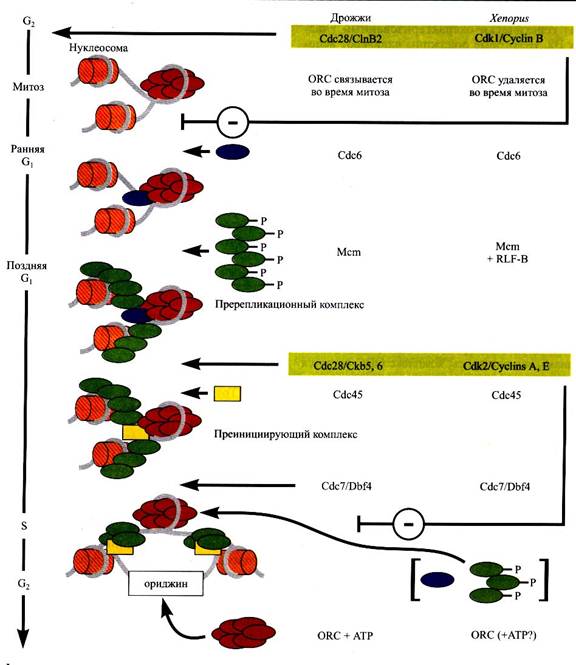
Рис… Схема инициации репликации у эукариот
Белком-инициатором репликации ДНК в клетках эукариот является ОRС (origin recognition complex), который впервые был описан для S. cerevisiae. Впоследствии ORC-подобные белки были обнаружены и изучены и у других представителей эукариот, у млекопитающих и человека. У всех эукариот ОRС образован шестью субъединицами – Огс1-Огс6 (120-50 кДа). Для жизнедеятельности S. cerevisiae существенны все шесть субъединиц комплекса. Две разные группы субъединиц ОRС участвуют в распознавании последовательностей ориджина при его связывании с ориджином репликации. Огс1, Огс2 и Огс4 взаимодействуют с АСS, остальные три субъединицы распознают B1- подобные элементы. Возможно, что связь с нуклеотидными последовательностями В1 осуществляет только Огс5. ОRС специфически связывается с ДНК только в присутствии АТР и обладает АТРазной активностью, которaя регулируется координированным взаимодействием белка с АТР и элементами АRS. АТР связывается с субъединицей Огс1 и играет роль кофактора, необходимого для присоединения ОRС к ориджину. Специфическая последовательность ориджина, связавшегося с ОRС, ингибирует АТРазную активность Огс1, в то время как однонитевые участки ДНК, появляющиеся в S-фазе, ее снова активируют. При этом меняется конформация ОRС - с вытянутой (ехtended) на изогнутую (bеnt). Возможно, связывание и гидролиз АТР субъединицей Огс1 участвуют в контролировании функций ОRС в клеточном цикле. У S. Роmbeбелок Огс4 содержит в N-концевом домене так называемые «АТ-крючки», с помощью которых ОRС связывается с несколькими областями АRS1, богатыми АТ-последовательностями. У S. cerevisiae ORS присоединяется к ориджину в конце митоза, образуя post-RС, и остается связанным с ним в последующих клеточных циклах. При этом post-RС существует в фазах S, G2 и М, а в фазе G1 входит в состав пререпликативного комплекса (рге-RС).
|
|
|
Пререпликативный комплекс формируется на основе post-RC, этот процесс начинается во всех ориджинах одновременно на границе фаз М и G1 и завершается в конце G1 в ориджинах, активирующихся первыми при переходе в S-фазу. В ориджинах, активирующихся позже в S-фазе, образование рrе-RC завершается в соответствующий для каждого из них период S-фазы. В G1-фазе во время сборки рrе-RС ОRС способен взаимодействовать с циклинзависимыми киназами (Сdks, cyclin-dependent kinase). Это взаимодействие является одним из механизмов, позволяющих клетке формировать рге-RC после митоза. Первыми к post-RC на границе фаз М/G1 присоединяются белок Сdс6 (cell division cycle proteins) и семейство шести белков Мсm2-7(minichromosome maintenance proteins), описанные у многих представителей эукариот, включая млекопитающих. Недавно было показано, что в клетках S. роmbе и высших эукариот в ранней стадии формирования рrе-RС участвует еще один белок – Cdt1(cell division termination). Белки Мсm2-7 являются наиболее известными среди семейства «поддерживающих мини-хромосомы» белков, впервые идентифицированных у S. cerevisiae при исследовании мутантов, не способных к поддержанию стабильности мини-хромосом. Белки Мсm2—7 образуют гексамерный комплекс (МСМ) - ключевой компонент рге-RС. МСМ генерирует контрольный сигнал на нереплицированном хроматине для ингибирования преждевременного митоза в G1-фазе. Также он необходим для продвижения клетки по циклу в S-фазу. Присоединение МСМ к ориджину репликации регулируется фосфорилированием-дефосфорилированием отдельных субъединиц этого комплекса. Например, частичное дефосфорилирование Мсm4-субъелиницы, гиперфосфорилированной в фазе М, способствует образованию рrе-RС, а полное дефосфорилирование МсmЗ-субъединицы инактивирует комплекс и препятствует его связыванию с хроматином. В тоже время, присоединение МСМ к ориджину зависит от белков Сdс6 и Сdt1, которые совместно «насаживают» МСМ на хроматин. В отсутствие Сdс6 клетки S. cerevisiae теряют способность инициировать репликацию ДНК и подвергаются «урезанному» митозу и нереплицированные хромосомы сегрегируют случайным образом к полюсам веретена. Способность Сdс6 предотвращать «урезанный» митоз до завершения репликации ДНК обеспечивается его взаимодействием с Cdks. Активность Сdс6 в фазе G1 регулируется также его взаимодействием с АТР, так как мутации в консервативных последовательностях АТР-связываюшего мотива Сdс6 приводили к потере cпособности хроматина присоединять МСМ в клетках S. cerevisiae и к подавлению репликации ДНК в клетках человека. У S. cerevisiae в присоединении МСМ к рrе-RС принимает участие еще один белок - Mcm10, который ассоциирован с хроматином и взаимодействует с компонентами Мсm2-7. Столь сложный кнтроль связывания МСМ с ориджином свидетельствует о том, что в клетке существует сложная система регуляторных механизмов, необходимая для недопущения повторного митоза при нереплицированном хроматине. Связывание МСМ сориджинами репликации необходимо для обеспечения стабильности генома. переводит хроматин |в состояние, за которым закрепилось название «разрешающего» репликацию (replication-liscensing). У кеенопуса для связывания МCM требуется наличие дополнительного фактора, носящего такое же название, RLF-B (герlication licensing factor B). Белки МCM обнаруживают аффинность к гистонам, а не к ДНК, в результате чего в конце G1-фазы весь пререпликативный комплекс прочно привязывается к хроматину непосредственно в участке ориджина репликации или рядом с ним.
|
|
|
В G1-фазе к частично сформированному рrе-RC присоединяется киназа Сdc7 со своей регуляторной субъединицей Dbf4 (Dbf4/Cdc7), а в поздней G1-фазе или на границе фаз G1/S - белок Сdс45 и связывающий однонитевую ДНК репликативный белок А (RРA, replication protein A). Взаимодействие между Сdс45 и Dbf4/Cdc7 в поздней G1 -фазе требуется для последующего «включения» репликации в ориджинах после сборки рге-RС.
Киназа Dbf4/cdc7 связывается с ori за некоторое время до того, как начинает выполнять свои функции. Присоединившись к рге-RС, киназа Dbf4/Cdc7 «ждет», когда активируются Сdk, и только после этого фосфорилирует свои субстраты. Роль «раннего» связывания этой киназы с ori пока остается неясной.
|
|
|
Связывание Сdс45 с хроматином зависит от белков Сdс6 и Мсm2 и от активности киназы Dbf4/Cdc7 и циклинзависимых киназ S-фазы (Cdk-S-фазы - Сdс28/Сkb5,6 у дрожжей и Сdk2/Сусlins А,Е у высших эукариот). Белок Сdc45 может быть фосфорилирован киназой Dbf4/Cdc7, но это происходит только после активации Cdk-S-фазы. Активность Cdk-S, в свою очередь, регулируется ингибитором Sic1, который в конце фазы G1 подвергается убиквитинзависимому протеолизу. Присоединение белка Сdс45 к рге-RС происходит в поздней G1-фазе клеточного цикла только на ориджинах тех репликонов, которые начинают синтез ДНК первыми при переходе к S-фазе. Cdk-S и Dbf4/Cdc7 -зависимое связывание Cdc45 с остальными ориджинами осуществляется в определенное для каждого из них время на протяжении всей S-фазы. Вероятный механизм присоединения Сdс45 к рге-RС таков: Dbf4/Cdc7, связавшись со всеми ориджинами репликации в фазе G1, после воздействия Cdk-S фосфорилирует Мсm2 в каждом ориджине в тот период фазы S, который определяется индивидуально для каждого ориджина. В результате фосфорилирования Мсm2 конформация комплекса МСМ меняется таким образом, что он приобретает способность связывать Сdс45. В то же самое время к рге-RС присоединяется белок RРА. Подобно Сdс45 RРА связывается с ориджином Cdk-S зависимым образом при участии Мсm2. Присоединение белков Сdс45 и RРА завершает сборку рге-RС. Сразу после завершения сборки рrе-RС происходит частичная его диссоциация, сопровождающаяся началом формирования RС. Белок Сdc6 первым диссоциирует из рге-RС при переходе из фазы G1 в S или даже ранее, подвергаясь фосфорилированию под действием Сdks, за которым следуют убиквитинирование и деградация. Этот путь инактивации Сdс6 показан как для низших эукариот, так и для некоторых представителей высших эукариот. В клетках человека уровень Сdc6 остается постоянным на протяжении всего клеточного цикла. Но при переходе в S-фазу Сdс6 транспортируется из ядра в цитоплазму. По всей видимости, и этот процесс регулируется Сdk. Удаление Сdc6р из ядра (путем гидролиза или транспортировки в цитоплазму) является одним из механизмов, предотвращающих множественные акты репликации в течение одного клеточного цикла.
|
|
|
Белок Сdt 1 также инактивируется после завершения формирования рrе-RС. При этом в клетках низших и Cdt1. периодически экспрессиpуется, накапливаясь в ядрах в фазе G1, в фазе G2 его уровень падает. У высших эукариот активность Сdt1 контролируется белком-ингибитором геминином, который отсутствует в клетках в фазе G1, накапливается на протяжении фаз S, G2 и частично - фазы М и исчезает в М-фазе на границе метафазы и анафазы.
В отличие от Сdс6 и Сdt1 белки Мсm2-7, RРА и Сdс45, диссоциировав из рге-RС, остаются связанными с хроматином в S-фазе во время синтеза ДНК.. Быстрое освобождение МСМ из рте-RС в клетках дрожжей обеспечивается взаимодействием между Мcm10 и Мсm7. Разъединению МСМ и Мсm10 способствует белок Сdс45.
Субъединицы Мсm4,6,7 комплекса МСМ обладают геликазной активностью, проявляющейся только при стимуляции под действием Cdk-S и киназы Dbf4/Cdc7. Белки Мсm2-7 существенны не только для инициации, но и для элонгационной фазы репликации, для прогрессии репликативных вилок. МСМ входит в состав RС и принимает участие в раскручивании дуплекса ДНК в репликативных вилках. В клетках человека связывание МСМ с ориджином при формировании RС осуществляется с участием белка Мcm10, который накапливается и образует комплекс с хроматином в S-фазе, в отличие от Мcm10 S. сеrevisiae. При переходе клеток из фазы G2 в М Мcm10 гиперфосфорилируется и диссоциирует из хроматина, а на границе фаз М/G1 он подвергается протеолизу по протеосомному механизму. Таким образом, фосфорилирование и протеолиз Мcm10 в клетках человека осуществляют отрицательную регуляцию активности МСМ после завершения репликации ДНК. Кроме того, отрицательная регуляция активности МСМ может быть результатом непосредственного фосфорилирования отдельных компонентов самого этого комплекса. Так, например, фосфорилирование Cdk специфических сайтов Мcm4 в фазе М приводит к потере геликазной активности Мсm4,6,7, а высокая концентрация комплекса Cdk-циклин Е в ядрах эмбрионов Хеnорus препятствует связыванию МсmЗ с ДНК и таким образом предотвращает реассоциацию МСМ с хроматином после завершения репликации. Комплекс МСМ участвует не только в ранних этапах инициации репликации при переходе клеток в фазу G1, но и в завершении этого процесса в фазе S. Причем, на завершающем этапе инициации репликации МСМ выполняет две функции: раскручивает ДНК в ориджине и служит остовом, к которому присоединяются остальные компоненты при формировании RС. Поэтому множественные механизмы регуляции активности МСМ вполне объяснимы. Если в фазе G1 эти механизмы направлены на осуществление продвижения клеток к фазе S без повторного митоза, то в фазах S и G2 они предотвращают повторную репликацию уже реплицированного хроматина.
RРА является белком, связывающим однонитевую ДНК и наличие его в RС при инициации репликации необходимо для стабилизирования расплетенного участка ДНК. RРА образован тремя субъединицами с молекулярными массами 70, 34 и 11 кДа, причем активностью, связывающей однонитевую ДНК, обладает субъединица 70 кДа, а субъединица 34 кДа является регуляторной. Последняя фосфорилируется Сdk, что, по-видимому, необходимо для активации репликации ДНК. Подробное описание этого комплекса будет дано ниже.
Белок Сdс45 также участвует в формировании RС. Он необходим для присоединения ДНК-полимеразы α к ориджинам репликации. Показано, что белок Сdс45 человека связывается с белком Мсm7 человека и субъединицей р70 ДНК-полимеразы α in vitro. Сdс45 присоединяет ДНК-полимеразу α к RС посредством связывания с Мсm7. В клетках дрожжей S. cerevisiae Сdс45 присоединяет ДНК-полимеразу α к хроматину с участием Мсm2.
Одним из компонентов комплекса, запускающего репликацию ДНК, является ДНК-полимераза α. Из всех многочисленных ДНК-полимераз эукариот именно она содержит праймазную активность, способную синтезировать короткий праймер из рибонуклеозидтрифосфатов. РНК-праймер генерирует сигнал, который является одним из пусковых механизмов репликации. ДНК-полимераза α обнаружена у всех исследованных эукариот и хорошо изучена. Подробное описание этого фермента будет дано в следующем разделе. Показано, что один из путей регуляции инициации репликации связан с фосфорилированием двух больших субъединиц ДНК-полимеразы α под действием Сdk. При этом циклин Е и Сdk стимулируют инициацию репликации при переходе клетки в S-фазу, а циклин А и Сdk ингибируют ее в фазе G2.
Очевидно, что активация упоминавшихся выше «ранне- и позднеактивных» ориджинов S. cerevisiae зависит от киназы Dbf4/Сdс7р. Вероятно, в каждом ориджине происходит локальная регуляция его активности дополнительными протеинкиназами, например Rad53. Киназа Rad53 блокирует запуск "позднеактивных" ориджинов в ранней S-фазе. Когда это блокирование устраняется, киназа Dbf4/Сdс7р активирует МСМ, что приводит сразу к нескольким последствиям: стимуляции геликазной активности МСМ и связыванию белка RРА и ДНК-полимеразы α с ориджинами репликации. Присоединение ДНК-полимеразы α к RС, раскручивание ДНК в ориджине и синтез РНК-праймера завершают процесс инициации репликации ДНК эукариот. Следует отметить, что роль ДНК-полимеразы α ограничивается только запуском репликации ДНК. Эта ДНК-полимераза не способна к процессивному синтезу ДНК и не обладает корректирующей активностью. Поэтому в дальнейшем в процессе репликации она добавляет к праймеру -20 нуклеотидов и замещается ДНК-полимеразами δ или ε.
Роst-RС, с образования которого начинается вся цепь событий процесса инициации репликации ДНК, в S-фазе клеточного цикла претерпевает изменения. Эти изменения касаются сродства ОRС к ДНК. Так, например, белок Orc1 Хепориs образует прочный комплекс с хроматином в ранней интерфазе до тех пор, пока не завершится сборка рrе-RС. Затем в S-фазе сродство Оrс1 к ДНК уменьшается. У млекопитающих Оrс1 диссоциирует из хроматина в S-фазе, превращается в моно- или диубиквитинированную форму, затем деубиквитинируется и вновь связывается с ДНК при переходе из М- в G-1-фазу. Белок Оrс2, напротив, остается связанным с хроматином на протяжении всего клеточного цикла и не является субстратом для убиквитинирования. В клетках человека в S-фазе из хроматина диссоциирует комплекс белков, содержащий Оrс1 и Оrс2, который реассоциирует в конце митоза. В клетках дрожжей S. роmbе ОRС подвергается посттрансляционным изменениям в клеточном цикле: в фазе S начинается фосфорилирование одной из его субъединиц, Оrс2, которое достигает максимума в фазах G2 и М. Таким образом, в клетках эукариот один из механизмов, предотвращающих повторную репликацию уже реплицированного хроматина, связан с инактивацией роst-RС либо путем диссоциации из него Оrс1 (у высших эукариот), либо путем фосфорилирования Оrс2 (у низших эукариот).
В последние несколько лет значительные успехи достигнуты в понимании механизмов регуляции практически каждой стадии инициации репликации. Они осуществляются на уровне функционирования всех компонентов, образующих пост-, пре- и репликативный комплексы. Эти компоненты подвергаются воздействию не одного, а ряда различных факторов. Примером этому служит регуляция комплекса МСМ, активность которого напрямую зависит от белков Сdc6, Мсm10, Сdt1, циклин-зависимых киназ, киназы Dbf4/Сdс7, фосфатаз. А если учесть и те факторы, которые мало понятны закономерности процесса инициации репликации ДНК в эмбриогенезе.
| Вид комплекса | Белки | Функции |
| Пострепликатив-ный (post-RC) | ORC (Orc1-6) | Связывается с ori и образует платформу для сборки pre-RC |
| Пререпликатив-ный (pre-RC) | ORC (Orc1-6) Cdc6 Cdt1 MCm10 MCM (Mcm 2-7) Dbf4/Cdc7 Cdc45 RPA | Присоединяет Cdc6 Связывает MCM c ori Связывает MCM c ori Связывает MCM c ori; способствует диссоциации MCM из pre-RC Генерирует контрольный сигнал, запрещающий повторный митоз; переводит хроматин в состояние, «разрешающее» репликацию, связывает Cdc45 c ori Участвует в связывании Cdc45 и RPA c ori; активирует геликазу MCM Высвобождает MCM из pre-RC Стабилизирует расплетенные однонитевые участки ДНК |
| Репликативный (RC) | Cdc45 MCM (Mcm 2-7) RPA polα | Присоединяет ДНК-поимеразу α к RC Расплетает ДНК; участвует в присоединении polα к RC Стабилизирует расплетенные однонитевые участки ДНК Синтезирует РНК-праймер; инициирует репликацию ДНК |
Таблица…. Комплексы инициации транскрипции у эукариот
 2015-04-12
2015-04-12 4258
4258








