1. Какие реакции называются окислительно–восстановительными (ОВР)?
2. Определите степень окисления хрома в следующих соединениях:
Cr2O3; K2CrO4; Na2Cr2O7; Cr2(SO4); Na3[Cr(OH)6]; (NH4)2Cr2O7.
3. В каких из приведенных процессов происходит окисление, а в каких – восстановление азота, как при этом изменяется его степень окисления:
NO3– ® NO; NO2– ® NO3–; NH4+ ® N2
4. Какие из следующих реакций относятся к ОВР:
| а) NH4Cl = NH3 + HCl | б) 4P + 3KOH + 3H2O = PH3 + 3KH2PO2 |
| в) NH4NO3 = N2O + 2H2O | г) 3Ge + 4HNO3 = 3GeO2 + 4NO + 2H2O |
| д) H2 + Br2 = 2NBr | е) H3BO3 + 4NF = H[BF4] + 3H2O |
| ж)SiCl4 + 2H2O = SiO2 + 4HCl | з) K3PO4 + 2H2O = KH2PO4 + 2KOH |
| и) GeO2 + H2O = H2GeO3 | к) (NH4)2Cr2O7 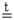 Cr2O3 + N2 + 4H2O Cr2O3 + N2 + 4H2O
|
5. Какие из следующих ионов могут выполнять функции восстановителей, а какие – окислителей:
Sn2+; I–; WO42–; ClO3–; NO3–; Au3+; S2–; FeO42–; Fe2+?
6. Какие из перечисленных веществ и за счет каких элементов проявляют окислительно–восстановительную двойственность: HI; Na2SO3; Mg; K2MnO4; PH3; CO; K2Cr2O7?
7. Расположите ионы Se2–, Te2–, S2– в порядке возрастания их восстановительной активности.
8. Расположите атомы Se, Te, S в порядке возрастания их окислительной активности. Какую роль могут выполнять неметаллы в ОВР?
|
|
|
9. К какому типу относятся следующие ОВР:
а) 2KMnO4 + 3MnSO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
б) 2H2O2 = 2H2O + O2
в) 3S + 6KOH = K2SO3 + K2S + 3H2O
г) 4P + 3KOH + 3H2O = PH3 + 3KH2PO2
д) 2K4[Fe(CN)6] + Br2 = 2KBr + 2K3[Fe(CN)6]
е) (NH4)2Cr2O7 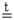 N2 + Cr2O3 + 4H2O?
N2 + Cr2O3 + 4H2O?
10. Какие факторы влияют на протекание ОВР?
11. Какую роль выполняют металлы в ОВР?
12. Используя ионно–электронный метод, закончите следующие ОВР, применяемые для травления металлических пленок, полупроводников и т.п.:
а) Cu + CrO3 + H2SO4 ® Cu2+ + Cr3+
б) Ag + H2O2 + NH4OH ® [Ag(NH3)2]+
в) Ti + HF + HNO3 ® [TiF6]2– +NO
г) Au + KBr + Br2 ® [AuBr4]–
д) Cr + KMnO4 + KOH ® [Cr(OH)6]3– + MnO42–
е) Si + HF + HNO3 ® [SiF6]2– +NO
ж) Cr2O3 + KOH + KClO3 ® CrO42– + Cl–
з) Nb + HNO3 + NH4F ® [NbF7]2– + NO
и) PbS + H2O2 ® PbSO4
к) Mo + K3[Fe(CN)6] + KOH ® MoO42– + [Fe(CN)6]4–
л) Al + H2O2 + HCl ® Al3+
м) Ag + CrO3 + H2SO4 ® Ag++ Cr3+
н) As2S3 + HNO3 + H2O ® H3AsO4 +H2SO4 + NO.
 2015-04-01
2015-04-01 579
579








