1)Теория активных столкновений (С. Аррениус) основана на том, что химическое взаимодействие осуществляется только при столкновении активных частиц, которые обладают достаточной энергией для преодоления потенциального барьера реакции и ориентированы в пространстве друг относительно друга. Чтобы произошла реакция, частицы в момент столкновения должны обладать некоторым минимальным избытком энергии, называемым энергией активации.
Количество соударений двух атомов:
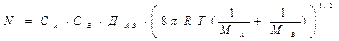
где СА,СВ− концентрация компонентов; ДАВ− эффективный диаметр двух взаимодействующих молекул.
Число столкновений велико и составляет величину N=1028.
Большинство реакций протекают очень медленно. Следовательно, не все соударения приводят к химическому превращению, а реагируют только те молекулы, чья суммарная энергия взаимодействия больше некоторого потенциального барьера, называемого энергией активацией. Молекула, взаимодействие которых не привело к хим.превращению, изменяет свою скорость, а след-но, и кинетическую энергию.
|
|
|
При увеличении температуры в 2 раза, кинетическая энергия возрастает также в 2 раза, а доля молекул, обладающих избыточной энергии, возрастает в 150 раз.
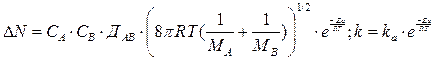
Данная теория согласуется с законом действующих масс, т. к. учитываются текущие концентрации взаимодействующих молекул. Также данная теория подчиняется и закону Аррениуса, т. к. Т, стоящая в экспоненте, оказывает более сильное влияние на долю молекул, обладающих избыточной энергии, нежели Т в степени ½.
2) В теории переходного состояния все выводы строятся на основании того, что в результате соударения между реагирующими молекулами или молекулами исходного вещества и катализатора образуется активный комплекс с очень коротким временем осуществления. Скорость хим. реакции – скорость диссоциации промежуточного комплекса.
А+Z↔[AZ]↔B+Z
Энергию исходных веществ и промежуточного комплекса можно записать через функцию распределения:
- поступательное движение:
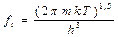 m- масса молекулы, k- пост. Больцмана, h-пост. Планка
m- масса молекулы, k- пост. Больцмана, h-пост. Планка
- колебательное движение:
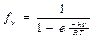 ν – частота колебаний молекулы.
ν – частота колебаний молекулы.
- вращательное движение:
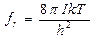 I – момент инерции молекулы.
I – момент инерции молекулы.
Необходимо также учитывать запас энергии, приносимый молекулам всеми электронами, который является суммой вращательных, поступательных, колебательных движений электронов и их перемещения. Т. к. комплекс находится в неустойчивом состоянии и диссоциирует, необходимо учитывать энергетический вклад распада комплекса на продукты реакции.
Порядок энергетического вклада в общий запас энергии является следующее: поступ.движение-10 8 ÷ 10 9; колеб.движ- 10 1 ÷ 10 2; вращательное - 10 0 ÷10 1
|
|
|
Энергетическое состояние любой молекулы F=ft∙fr∙fv
Согласно данной теории: W=[AZ]∙ν’
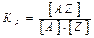
Тогда: W=KP∙[A]∙[Z]∙ν’, где 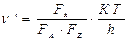 , где КР=е-Еа/RT
, где КР=е-Еа/RT
Итоговое уравнение: 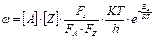
Полученное уравнение согласуется с законом действующих масс, т. к. учитываются концентрации исходных веществ. Оно подобно уравнению Аррениуса, т. к. Т, стоящая в экспоненте, оказывает более сильное влияние на скорость хим. реакции, чем температура Т. Данная теория специфична конкретно для каждой реакции, т. к. учитываются не только энергетические состояния исходных веществ, но и энергетические состояния образованных промежуточных комплексов.
 2015-04-17
2015-04-17 1195
1195








