Реакции гидрирования можно разделить на 3 группы:
1) присоединение водорода по ненасыщенным связям;
2) действие водорода, сопровождающееся отщеплением воды или других веществ, не содержащих углерода;
3) реакции с водородом, сопровождающиеся ращеплением углерод-углеродных связей (деструктивное гидрирование).
Все реакции гидрирования являются экзотермическими. Процессы гидрирования из термодинамических соображений следует проводить при возможно более низкой температуре, позволяющей, однако, достичь приемлемой скорости реакции. В промышленной практике температура колеблется от 100 до 350-400 ºС (в зависимости от активности катализаторов и реакционной способности исходного вещества). Поскольку при гидрировании (ввиду поглощения водорода) всегда происходит уменьшением объема, то для увеличения равновесной степени конверсии очень часто (особенно при сравнительно высоких температурах) используют повышенное давление. В промышленной практике применяют давление от 1,5-5 до 30-40 МПа.
Другой метод повышения равновесной степени конверсии состоит в применение избытка водорода по сравнению со стехиометрическим, что широко используется для гидрирования в газовой фазе. Например, гидрирование бензола при ≈ 0,1 МПа, 200 ºС и мольном соотношении С6Н6: Н2=1:3 дает равновесную степень конверсии 95,7%, которая при 10-кратном избытке водорода повышается до 99,5 %.
Катализаторы разделяют на 3 группы:
1) Ме VIII группы (Fe, Co, Ni, Pd, Pt) и IБ подгруппы (Cu, Ag) периодической системы, а также смеси этих металлов (сплавы);
2) оксиды металлов (MgO, ZnO, Cr2O3, Fe2O3)
3) сложные оксидные и сульфидные катализаторы, состоящие из смеси оксидов или сульфидов (медь- и цинкхромооксидные CuO∙ Cr2O3 и ZnO∙ Cr2O3, кобальтмолибденоксидные- СоО∙МоО3, никель- и кобальтвольфрамоксидные- NiO∙WO3, CoO∙WO3).
Эти вещества, особенно Ме, часто наносят на пористые носители и добавляют к ним различные промоторы - оксиды других Ме, щелочи и др. Катализаторы применяют от тонкодиспергированных в жидкости до формованных (в виде цилиндров, колец, таблеток). Она обладают различной активностью и селективностью для каждого конкретного процесса, причем пока не найдено каких-либо общих закономерностей, определяющих оптимальный выбор катализатора.
Олефины, ароматические соединения и еще в большей мере ацетилен и его гомологи обладают высокой способностью к сорбции Ме, которая протекает в основном за счет частичного или полного раскрытия ненасыщенной связи:
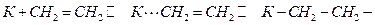
Оксидные катализаторы ведут себя подобным же образом, но их способность к хемосорбции водорода и углеводородов меньше, чем у Ме. Органические кислород- и азотсодержащие соединения лучше сорбируются на оксидных катализаторах, чем на металлах.
Дальнейшее взаимодействие протекает следующим образом:
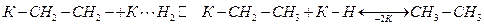
Температура оказывает на процесс гидрирование небольшое влияние. Обычно при увеличении Т на 30-50 ºС скорость примерно удваивается, что соответствует Еа=21-42 кДж/моль.
По способности к гидрированию разные классы располагаются:
олефины>ацетилен и его производные> ароматические УВ.
 2015-04-17
2015-04-17 1238
1238








