Лекция №3. Материальный баланс процессов горения.
Цель лекции: Научить студентов составлять уравнения материального баланса процессов горения и производить расчеты основных количественных показателей, ознакомить курсантов с причинами возникновения дыма при пожаре и опасными факторами пожара, вызванными дымом.
План лекции
1. Уравнение материального баланса. Количественная оценка горючих веществ.
2. Расход воздуха на горение.
3. Расчет количества и состава продуктов горения.
4. Дым и его основные свойства.
Методическое обеспечение:
1.Конспект лекции.
2.Графопроектор.
Процессы горения на пожаре подчиняются фундаментальным законам природы, в частности, законам сохранения массы и энергии. На них базируется большинство инженерных расчетов параметров процессов горения.
1. Уравнение материального баланса
Баланс (от фр. balance - весы) - совокупность показателей для оценки какого-либо явления путем сопоставления или противопоставления отдельных его сторон. Для процессов массо- и теплообмена баланс - это математическое выражение закона сохранения массы или энергии, которое связывает значения массы или теплоты исходных (приход) и конечных (расход) веществ. При этом приход всегда равен расходу.
Схематично с учетом прихода и расхода материальный баланс можно представить в виде:
Горючее + окислитель = Продукты горения
Приход Расход
В процессах горения исходными веществами являются горючее и
окислитель, а конечными - продукты горения. Последние представляют собой многокомпонентную смесь: в общем виде: ПГ1 + ПГ2 +...+ ПГi +... + ПГn = SПГi
Например:
СО2 + СО + Н20 + Ств +...
Материальный баланс процессов горения основывается на уравнении основного химического процесса при горении: окислительно восстановительной реакции между исходными горючими веществами и окислителем с образованием продуктов горения ПГ (конечные вещества), представленному уравнением (1).
Гор + yОк = 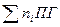 (1)
(1)
Где: Гор – горючее вещество,
Ок – окислитель,
ПГ – продукты горения.
x,y,ni – соответствующие стехиометрические коэффициенты.
Как уже отмечалось выше, данное уравнение является обобщенным выражением материального баланса любой химической реакции окисления. Оно не несет информации о промежуточных стадиях процесса, которых может быть великое множество, а выражает только начальное и конечное состояние системы. Поэтому его называют также суммарным или брутто-уравнением реакции горения. Для решения многих инженерно-технических задач этого уравнения бывает достаточно. Рассмотрим расчетные методы определения отдельных составляющих материального баланса процессов горения.
2.Расход воздуха на горение
Чаще всего на реальных пожарах приходиться иметь дело с горением в атмосфере воздуха. Известно, что основными компонентами воздуха являются азот (78%), кислород (21%) и аргон (0,9%). Азот и инертный газ аргон в процессе горения органических веществ участия не принимают. Окислителем при горении в воздухе является кислород.
Для простоты расчетов принимают, что воздух состоит из 21% кислорода и 79% азота, т.е. на один объем кислорода в воздухе приходится 79/21=3,76 объема азота.
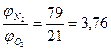
где 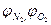 - соответственно объемное (объемных процентах) содержание азота и кислорода в окислителе.
- соответственно объемное (объемных процентах) содержание азота и кислорода в окислителе.

Таким образом, состав воздуха может быть представлен в виде:
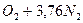
Теоретический расход воздуха на горение рассчитывается по уравнению материального баланса горения с учетом стехиометрических коэффициентов без учета участия воздуха в других физических процессах, протекающих при горении.
Общее уравнение материального баланса процесса горения в воздухе выглядит следующим образом:
Гор + b(О2 + 3,76N2) = S ni [ПГi] + b×3,76N2. (2)
где 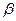 - стехиометрический коэффициент перед воздухом, участвующем в
- стехиометрический коэффициент перед воздухом, участвующем в
химических превращениях при горении.
Смеси стехиометрического состава наиболее пожарно- и взрывоопасны.
Удельный теоретический расход воздуха Vв ° - это минимальное его количество, необходимое для полного сгорания единицы массы горючего вещества при нормальных условиях.
Алгоритм расчета теоретического количества воздуха на окисление зависит от агрегатного состояния вещества и его химической природы. Для удобства вычислений горючие вещества подразделяют на три основные группы:
- индивидуальные химические соединения с известной химической формулой (метан, ацетон, спирты и т.д.);
- горючее – смесь газов (природный, нефтяной, промышленный – генераторный, доменный и др.
- конденсированные горючие вещества неизвестного химического строения, но с известным элементным составом (.элементный состав отражает содержание в веществе химических элементов С, Н, О, S, N, C1 и др. в % масс.); смесь газов или паров.
2.1. Коэффициент избытка воздуха.
На реальных пожарах количество участвующего в открытом горении воздуха больше теоретического. Это объясняется тем, что теоретический расход воздуха рассчитывается только по уравнению химической реакции окисления, а при горении воздух принимает участие и в физических процессах (конвекции, диффузии), обеспечивающих поддержание устойчивого процесса горения. При диффузионном режиме для поддержания устойчивого горения необходима достаточная скорость диффузии кислорода из окружающего воздуха через фронт пламени в зону горючих газов. При градиенте концентраций 21%(воздух) - 0% (ГГ) эта скорость достаточна, при понижении концентрации кислорода в воздухе до 16-14% (например, при горении в замкнутом объеме) скорость диффузии значительно уменьшается и горение прекращается.
Поэтому было введено понятие коэффициент избытка воздуха.
Коэффициент избытка воздуха a - это отношение количества воздуха, практически расходуемого на горение, к теоретическому количеству, необходимому для полного химического окисления горючего в соответствии с уравнением (4).
a = Vвпр / Vв0 = 
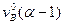 (3)
(3)
 Коэффициент избытка воздуха показывает, во сколько раз реальный расход воздуха при горении больше теоретического, рассчитанного только по уравнению химической реакции.
Коэффициент избытка воздуха показывает, во сколько раз реальный расход воздуха при горении больше теоретического, рассчитанного только по уравнению химической реакции.
 Коэффициент избытка воздуха имеет смысл только при описании процессов горения в замкнутых объемах.
Коэффициент избытка воздуха имеет смысл только при описании процессов горения в замкнутых объемах.
Для горючих однородных смесей стехиометрического состава коэффициент избытка воздуха a = 1, т.е. реальный расход воздуха, приведенный к нормальным условиям, равен теоретическому. При a > 1 горючую смесь называют бедной по горючему компоненту, а при a < 1 - богатой. В бедной смеси имеется избыток воздуха, который не расходуется и переходит в продукты горения. При диффузионном режиме горения предварительно не перемешанных горючих смесей коэффициент избытка воздуха всегда больше 1.
Разность между практическим и теоретическим количеством называется избытком воздуха.
Его можно вычислить по формулам:
D Vв = Vвпр - Vв0 (4)
Диффузионное горение большинства горючих материалов возможно только до определенной пороговой концентрации кислорода (для большинства органических веществ до 12-16 % об. О2). Зная содержание кислорода в продуктах горения jО2пг, можно определить коэффициент избытка воздуха на реальном пожаре:
a = 21/(21 - jО2пг) (2.5)
и далее - практический расход воздуха на горение.
2.2.Расчет количества воздуха, необходимого на горение, если горючее - индивидуальное химическое соединение
В этом случае теоретическое количество воздуха Vв° определяется непосредственно из уравнения материального баланса с помощью известного следствия из закона Авогадро. Рассмотрим расчет теоретического количества воздуха на горение на примере ацетона.
Пример 1. Сколько теоретически количества воздуха необходимо для сгорания 1 кмоля ацетона при нормальных условиях?
Решение:
Уравнение реакции горения ацетона в воздухе:
С3Н6О + 4 (O2 + 3,76N2) = ЗСO2 +ЗН2O + 4×3,76N2.
1 кмоль 4(1+3,76)кмоль
По уравнению на 1 кмоль ацетона расходуется 4(1+3,76) = 19,04 кмоля воздуха.
Однако размерность Vв0 может быть разной. На практике удобно выражать расход воздуха на горение в м3. Известно, что 1 кмоль газа при нормальных условиях занимает объем 22,4 м3/кмоль, поэтому необходимый объем воздуха на горение 1 кмоль ацетона при нормальных условиях будет равен Vb° = 22,4×19,04 = 426,5 м3 /кмоль.
Если ацетон находится в виде пара, то его 1 кмоль при нормальных условиях тоже будет занимать объем 22,4 м3. Тогда расход воздуха на горение можно выразить в м3/м3, и он будет равен Vв0 = 19,04 м3 воздуха /м3 паров ацетона.
Молекулярная масса ацетона Мацетона= 12×3+6+16=58, т.е. масса 1 кмоля равна 58 кг. Отсюда, в расчете на 1 кг ацетона Vв° = 426,5/58 = 7,35 м3/кг.
В табл.2 приведены результаты выполненных вычислений.
Таблица 1.
Теоретический расход воздуха на горение ацетона
| Параметр | Размерность | |||
| моль/кмоль | м3 /м3 | м3/кмоль | м3/кг | |
| Vb° | 19,04 | 19,04 | 426,5 | 7,35 |
Как видно из таблицы, величина Vв ° зависит от ее размерности.
В общем виде ход приведенных вычислений расхода воздуха на горение любого вещества можно записать с помощью простых формул:
Vв° = b×(1 + 3,76) = 4,76×b, кмоль/кмоль (5),
где b - стехиометрический коэффициент воздуха в уравнении материального баланса горения вещества.
Vв0 = 22,4×4,76×b = 106,6×b, м3 /кмоль (6),
Vв° = 106,6b/Мг, м3/кг (2.8),
где Мг - молекулярная (атомная) масса горючего, кг/кмоль.
Если нужно привести теоретический объем воздуха к условиям, отличным от нормальных, то используется известная формула объединенного газового закона:
PoVв°/To = PtVвt/T (7). 
2.3. Расчет количества воздуха, необходимого на горение, если горючее - смесь газов
К ним относятся ископаемые (природный, попутный нефтяной) и промышленные (доменный, коксовый, генераторный и т.п.) газы. Наиболее распространенные из них содержат СН4, С2Н6, Н2О, СО, Н2, N2 и др. Состав газов выражается обычно в объемных процентах.
Алгоритм расчета:
1) Составляется уравнение материального баланса для каждого газа.
2) Определяется 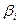 для каждого газа.
для каждого газа.
3) С учетом объемной концентрации каждого горючего компонента газовой смеси 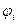 рассчитываем расход воздуха на горение газовой смеси по формуле:
рассчитываем расход воздуха на горение газовой смеси по формуле:

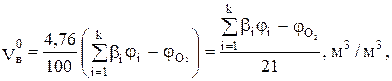 (8)
(8)
где bi - стехиометрический коэффициент при воздухе в уравнении
горения i-го компонента горючей смеси;
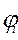 и
и 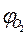 - концентрации i-го горючего компонента и кислорода (если таковой изначально имелся в смеси), % об.;
- концентрации i-го горючего компонента и кислорода (если таковой изначально имелся в смеси), % об.;
k - число горючих компонентов в смеси.
Пример 2. Определить объем воздуха, необходимого для горения 5 м3 смеси газов, состоящих из 20% СН4, 40% С2Н2, 10% СО, 5%N2 и 25% О2. если коэффициент избытка воздуха равен 1,8.
Решение:
Горючее смесь газов, поэтому воспользуемся формулой (8), предварительно составив уравнения горения горючих компонентов смеси
СН4 +2(О2+3,76 N2) =CО2 + 2Н2О + 7,52 N2
C2Н2 + 2,5(О2+3,76 N2) =2CО2 + Н2О + 9,4N2
СО + 0,5(О2+3,76 N2) =CО2 + 1,9 N2
Тогда
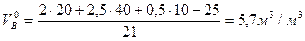
Для горения 5 м3 газовой смеси необходимый теоретический объем воздуха составит
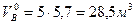 ,
,
Практическое количество воздуха, необходимое для сгорания этой смеси газов:
VВ = 1,8 28,5 =51,3 м3
2.4. Расчет количества воздуха, необходимого на горение, если горючее - конденсированное вещество неизвестного строения, но с известным элементным составом
Такими веществами являются, например, древесина, торф, каменный уголь, полимеры и др. При их горении кислород воздуха расходуется на окисление элементов С, Н, S и др. Здесь при определении Vв° необходимо обязательно учитывать кислород, содержащийся в самом веществе.
Алгоритм расчета:
1) Определение количества воздуха на горение каждого элемента 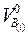 С, Н, S, мг3/кг. Теоретическое количество воздуха для каждого элемента определяется с помощью рассмотренных ранее выражений.
С, Н, S, мг3/кг. Теоретическое количество воздуха для каждого элемента определяется с помощью рассмотренных ранее выражений.
2) Суммирование 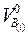 с учетом массовых концентраций элементов С, Н, S
с учетом массовых концентраций элементов С, Н, S
3) Вычитание 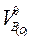 - объем воздуха, в котором содержится 1 кг кислорода м3/кг.
- объем воздуха, в котором содержится 1 кг кислорода м3/кг.
Теоретическое количество воздуха для конденсированного вещества равно сумме теоретических расходов воздуха на горение каждого элемента и может быть вычислено по формуле:
Vb° = Vb°[c] × C/100 + Vb°[h] ×H/100 + Vb°[s] ×S/100 - Vb°[o] ×O/100, м3/кг (9),
где Vb°[C, H, S] - теоретическое количество воздуха, необходимое для
горения элементов С, Н и S м3 /кг;
Vb°[O] - объем воздуха, в котором содержится 1 кг кислорода, м3/кг;
С, Н, S, О - содержание элементов в горючем веществе, % масс.
соответственно.
Пример 3. Определить объем и массу воздуха, необходимого для сгорания 1кг органической массы состава: С-60%, Н-5%, О-25%, N-5%, W (влажность)-5%, если коэффициент избытка воздуха 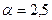 , температура воздуха 305 К, давление 99500 Па.
, температура воздуха 305 К, давление 99500 Па.
Решение: 
Так как горючее – материал, строение которого неизвестны, теоретическое количество воздуха при нормальных условиях определим по формуле (9)
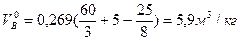
Пользуясь формулой (3) рассчитаем практическое количество воздуха при нормальных условиях
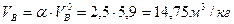
Находим объем воздуха, необходимого для горения вещества при данных условиях.
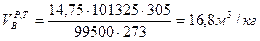

Массу воздуха определяем по формуле
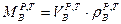 кг/кг
кг/кг
Определим плотность воздуха при заданных условиях, воспользовавшись объединенным газовым законом и зная, что плотность воздуха при нормальных условиях 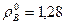 , кг/м3.
, кг/м3.
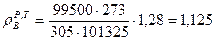 , кг/м3.
, кг/м3.
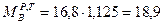 кг/кг
кг/кг
Пример.3 Определить объем продуктов горения при сгорании 1кг органической массы состава: С-55%, О-13%. Н-5%, S-7%,N-3%, W-17%, если температура горения 1170К, коэффициент избытка воздуха – 1,3.
Теоретический состав продуктов горения при нормальных условиях
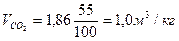
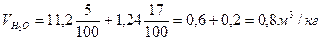
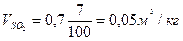
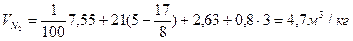
Полный теоретический объем продуктов горения при нормальных условиях
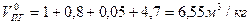
Практический объем продуктов горения при нормальных условиях
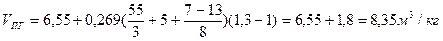
Практический объем продуктов горения при температуре горения
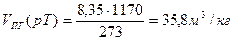
Пример. Рассчитать объем продуктов горения при сгорании 1 м3 газовой смеси, состоящей из 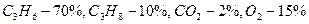 , если температура горения 1300К, коэффициент избытка воздуха 2,8. Температура окружающей среды 298 К.
, если температура горения 1300К, коэффициент избытка воздуха 2,8. Температура окружающей среды 298 К.
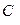
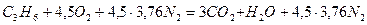
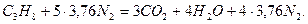
Объем продуктов горения определим по формуле
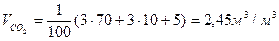
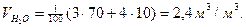
Так как газовая смесь содержит в составе кислород
3. Расчет количества и состава продуктов горения
Состав продуктов горения зависит от химической природы горючего материала и условий его горения. Практически повсеместно органические вещества горят с образованием продуктов полного и неполного горения.
К продуктам полного горения относятся: диоксид углерода СО2, образующийся при горении углерода, разложении карбонатов и т.д., водяной пар, образующийся при горении водорода и испарении влаги исходного вещества, сернистый ангидрид SO2 и азот N2 - продукты горения, соответственно, серу- и азотсодержащих соединений. Все они не горючи и не могут поддерживать горение.
Продукты неполного горения - это оксид углерода, сажа, продукты термоокислительного разложения (газы, смолы и т.п.). Неорганические вещества сгорают, как правило, до соответствующих оксидов.
Реальный выход продуктов горения количественно установить невозможно из-за чрезвычайной сложности их состава, поэтому материальный баланс процесса горения рассчитывается в предположении, что вещество сгорает полностью до конечных продуктов. При этом в состав продуктов горения включаются также азот воздуха, израсходованного на горение, и избыток воздуха при a > 1. Вычисление количества продуктов горения базируется на уравнении материального баланса процесса горения следующего вида:
Гор + b(02 + 3,76N2) = nСС02 + nНH2О + nSS02 + nNN2 + b3,76N2 + DVв. (10)
Алгоритм расчета зависит от состава и агрегатного состояния горючего вещества.
3.1. Горючее - индивидуальное химическое соединение.
Теоретический выход продуктов горения VПГ° при нормальных условиях определяется непосредственно из уравнения реакции горения.
Для твердых и жидких веществ:
VПГ° = (nС + nH + nS + nN + b3,76)×22,4/M, м3/кг. (11)
Для газов: VПГ° = nС + nH + nS + nN + b3,76, м3 /м3. (12)
где nС, nH, nS, nN – стехиометрические коэффициенты в уравнении материального баланса (10).
При a > 1 общий практический объем продуктов горения равен:
VПГпр = Vв0 + DVв. (13)
Объем продуктов горения от нормальных условий к любым другим может быть приведен по известной формуле (7).
Состав продуктов горения:
теоретический ji0 = Vi0 / Vпг°×100, % об, (14)
практический ji = Vi0 / Vпгпр×100, % об (15)
jв = DVв / Vпгпр×100% об. (16)
Пример 4. Рассчитать, какое количество продуктов горения выделится при сгорании 5 м3 ацетилена в воздухе, если температура горения 1450К.
Решение.
Запишем уравнение химической реакции горения
С2Н2 + 2,5 О2 + 2,5 3,76 N2= 2CО2 +Н2О + 2,5 3,76 N2
Поскольку горючее газообразное индивидуальное химическое соединение для расчета объема продуктов горения при нормальных условиях воспользуемся формулой (12):
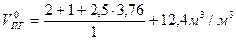
Объем продуктов горения 1 м3 ацетилена при 1450К
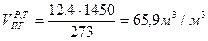
Объем продуктов горения м3 ацетилена при 1450К
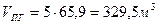
3.2. Горючее - конденсированное вещество неизвестного строения,
но с известным элементным составом.
В этом случае теоретический выход продуктов горения определяется как сумма продуктов горения каждого элемента, входящего в состав вещества. Для углерода:
С + (02 + 3,76N2) =СО2 + 3,76N2.
Теоретический выход диоксида углерода и азота в расчете на 1 кг углерода по уравнению горения будет равен:
VСО2° = mС×22,4 / MС = 1×22,4 /12=1,87 м3 /кг, (17)
VN2° = b×3,76×22,4 / MN =1×3,76×22,4 /14 = 7,0 м3/кг (18).
Аналогично вычисляются объемы продуктов горения на 1 кг водорода и серы. Если в самом веществе содержится кислород, то на такое же количество, соответственно, снижается расход кислорода на горение и эквивалентное ему количество азота в продуктах горения. Это в расчете на 1 кг кислорода в веществе при нормальных условиях составит:
-VN20 = 3,76×22,4 / МО = 3,76×22,4 / 28 = - 2,63 м3 /кг (19).
Органический азот переходит в продукты горения в молекулярном виде, объем его 1 кг будет равен:
VN20 = 22,4 / 28 = 0,8 м3 /кг (20).
Аналогично для влаги W (% масс.), содержащейся в горючем веществе:
VH2O0 = 22,4/18 = 1,24м/кг (21).
Полученные значения выходов продуктов горения элементов приведены в таблице 2.
Таблица 2.
 2015-04-17
2015-04-17 7446
7446








