Пример 1. Константа скорости реакции омыления этилового эфира уксусной кислоты едким натром при 283 К равна 2,38, если концентрацию выражать в кмоль/м3, а время в минутах. Вычислить время, необходимое для омыления 50% этилацетата, если смешать при 283К 1 литр 1/20 М раствора эфира с 1 л 1/20 М щелочи.
Решение. Концентрации эфира и щелочи равны, поэтому для решения следует использовать уравнение (1.19):
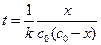 .
.
Так как общий объем смеси равен 2л, то:
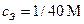 , x = 1/80 М.
, x = 1/80 М.
Концентрация вещества, выраженная в кмоль/м3 и в моль/л имеет одно и то же значение.
Тогда: 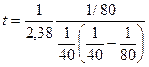 = 16,8 мин.
= 16,8 мин.
Пример 2. Раствор уксусноэтилового эфира при с 01 = 0,01М и Т =293 К омыляется 0,002 М (с 02) раствором едкого натра за время t 1=23 мин. на 10%. В какое время (t2) тот же раствор эфира прореагирует на 10% с раствором щелочи концентрацией 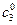 = 0,004 м/л
= 0,004 м/л
Решение. Эта реакция второго порядка, начальные концентрации исходных веществ не равны. Следовательно, для расчета константы скорости реакции воспользуемся уравнением (1.24):
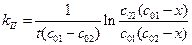 ;
;
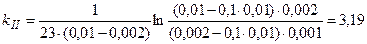 мин.-1×моль-1.
мин.-1×моль-1.
Зная значение константы скорости реакции, находим время t2:
|
|
|

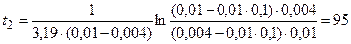 мин.
мин.
Пример 3. Исследование a - радиоактивного изотопа полония показало, что за 14 дней его активность уменьшилась на 6,85 %. Определить период полураспада и рассчитать, в течение какого времени он разлагается на 90 %. То есть в задаче дано:
С 0 = 100 %; х = 6,85 %; t = 14 дней.
Решение. Эта реакция относится к реакциям первого порядка.
1) Константу скорости можно рассчитать по уравнению (1.12):
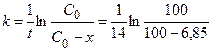 = 5,07×10-3 дней-1.
= 5,07×10-3 дней-1.
2) Период полураспада рассчитаем по уравнению (1.17):
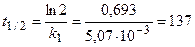 дней.
дней.
3) Рассчитаем промежуток времени, за который изотоп разложится на 90 %:
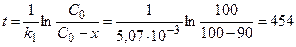 дня.
дня.
Вопросы и задания для самоконтроля.
1. Приведите примеры химических реакций второго порядка. В каком случае их можно считать бимолекулярными?
2. Какой вид примет кинетический закон для реакции второго порядка при условии с А0 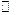 с В0?
с В0?
3. Укажите графический способ определения константы скорости для реакции второго порядка, когда с А0 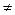 с В0. В каких координатах кинетическое уравнение имеет вид прямой линии?
с В0. В каких координатах кинетическое уравнение имеет вид прямой линии?
4. Представьте графически зависимость текущей концентрации реагирующего вещества от времени для реакций различных порядков (с А0= с В0= с С0: а) 0; б) 1; в) 2; г) 3.
5. Можно ли применять понятие времени полупревращения для реакций второго порядка, когда с А0 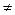 с В0?
с В0?
Получите аналитические выражения для времени полупревращения по каждому веществу.
 2015-04-01
2015-04-01 14612
14612








