Для элементарной бимолекулярной реакции

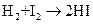
получены опытные значения предэкспоненциального множителя А =1,56·1011(л/моль·с) и энергия активации Е =78,9 Кдж/моль при р 0= 1 атм. Рассчитайте с помощью теории активированного комплекса при 689 К:
а) энтальпию активации 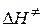 ; б) энтропию активации
; б) энтропию активации 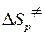 и
и 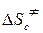 ; в) энергию Гиббса активации
; в) энергию Гиббса активации 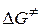 .
.
Р е ш е н и е. Выскажем предположение, что 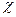 =1.
=1.
1. Рассчитаем значение константы скорости по формуле:
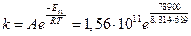 =1,79·105 л/моль·с
=1,79·105 л/моль·с
2. Энтальпия активации 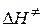 связана с опытной энергией активации соотношением:
связана с опытной энергией активации соотношением:
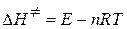 ,
,
где n – молекулярность реакции. В данном случае n =2. Тогда
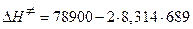 =67443,308 Дж/моль.
=67443,308 Дж/моль.
3. Энтропия активации равна:
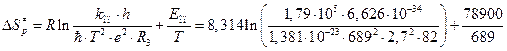 =
=
= -143,97 Дж/моль×К.
4. Если стандартное состояние С 0 = 1 моль/л, то R4 =0,082 л∙атм/ моль·К, тогда:
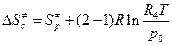 = -143,97 + 8,314
= -143,97 + 8,314 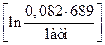 = - 110,43 Дж/моль.
= - 110,43 Дж/моль.
5. 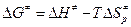 = 67443,308 -689×(-110,43) = 143529,578 Дж/моль=143,53 кДж/моль.
= 67443,308 -689×(-110,43) = 143529,578 Дж/моль=143,53 кДж/моль.
6. 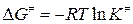 ;
; 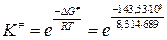 = 1,55·10-11.
= 1,55·10-11.
Вопросы и задания для самоконтроля.
1. В чем заключается основная идея теории активных столкновений?
2. Совпадают ли константа скорости, рассчитанная по теории активных столкновений с константой скорости, определенной из опыта?
3. Физический смысл стерического фактора Р.
4. В чем заключается основная идея теории переходного состояния? Есть ли различие в понятиях «переходное состояние» и «активированный комплекс»?
5. Приведите уравнение, связывающее константу скорости с энтропией активации и опытной энергией активации.
6. Гидролиз метана при температуре 1200 К отвечает кинетике реакции первого порядка. Используя опытные значения энергии активации Е = 335 кДж/моль и значение предэкспоненциального множителя 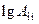 =12,2, вычислите при этой температуре энтальпию и энтропию активации реакции.
=12,2, вычислите при этой температуре энтальпию и энтропию активации реакции.
 2015-04-01
2015-04-01 2159
2159








