В теплотехнических расчетах и исследованиях широко используется функция состояния, называемая энтропией (от греческого слова tropos — превращение или преобразование). Название «энтропия» было введено Клаузиусом в 1865 г. Само название говорит об использовании этой функции в исследовании процессов преобразования энергии.
Энтропия (S) такое же свойство вещества, как, например, температура и другие. Ее относят к функциям состояния системы.
Для того, чтобы охарактеризовать состояние вещества существует два способа. Первый способ заключается в том, чтобы описать макросостояние вещества, иными словами указать его температуру, давление, объем, состав. Для осуществления второго способа необходима информация о микросостоянии вещества. Это означает, что необходимо охарактеризовать каждый атом вещества, т.е. дать его координаты в пространстве, частоты колебаний, вращательного движения, силовые постоянные и т.д. При современном уровне развития техники сделать последнее весьма сложно, а порой и невозможно. Поэтому был введен параметр, связывающий микро- и макросостояния вещества или системы.
Число микросостояний, отвечающих одному макросостоянию системы, называется вероятностью состояния системы. Обозначают указанную величину W.
Энтропия связана с вероятностью состояния системы формулой Больцмана:
S=klnW,
где k – постоянная Больцмана.
Исходя из вышесказанного, энтропию можно рассматривать как меру неупорядоченности системы.
Любой процесс, протекающий с уменьшением упорядоченности (диссоциация, нагревание и т.д.) сопровождается увеличением энтропии.
Для более ясного понятия сущности энтропии рассмотрим произвольный обратимый процесс 1-2. (рис. 9).
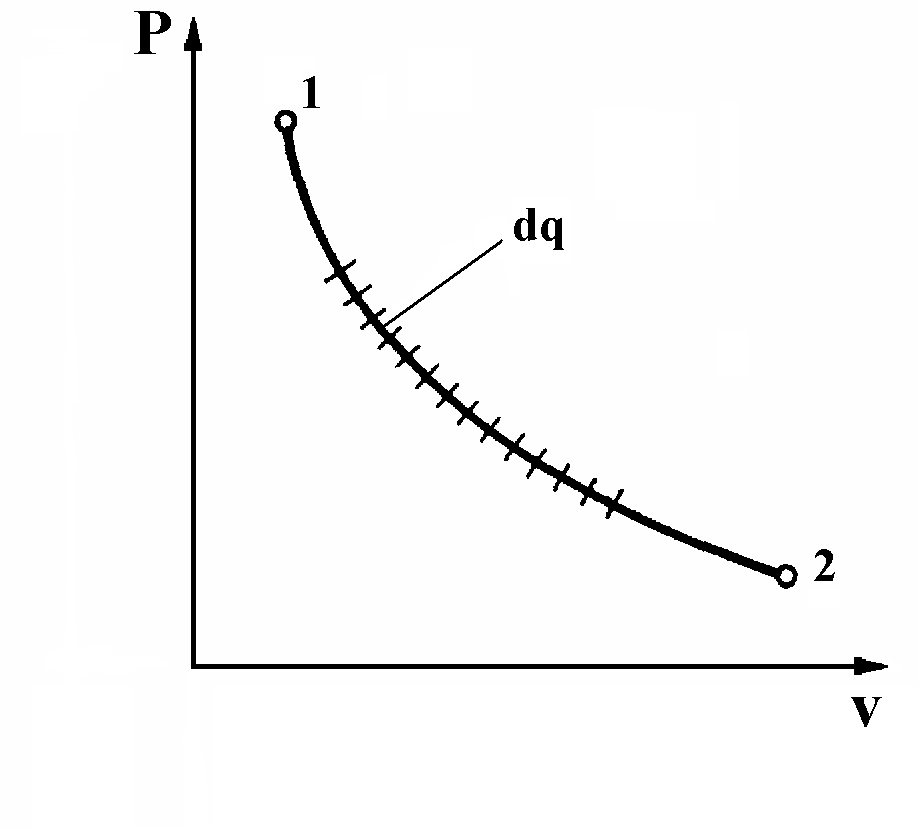
Рис. 9. К определению энтропии газа в процессе изменения его состояния.
Весь процесс от точки 1 до точки 2 разобьем на бесконечно большое число бесконечно малых отрезков. Ввиду малости отрезков примем, что температура рабочего тела на каждом элементарном участке процесса постоянна. Для каждого такого участка отношение бесконечно малого количества теплоты dq, подводимой к рабочему телу на этом участке, к температуре Т, при которой эта теплота была подведена, представляет собой бесконечно малую величину, обозначаемую ds.
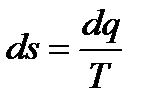
Т.о. представляет собой функцию, изменение которой в элементарном процессе равно отношению элементарного количества теплоты к температуре в этом процессе. Единицами измерения энтропии является Дж/К
На практике применяют понятие удельной энтропии, т.е. энтропия массы газа (Дж/кг×К)
Из представленного выше соотношения видно, что энтропия может как возрастать, так и убывать. Т.к. температура всегда положительна, то энтропия имеет тот же знак, что и теплота. Подвод теплоты (dq > 0) приводит к возрастанию энтропии системы (ds > 0), в то время как отвод тепла (dq < 0) приводит к убыли её энтропии (ds < 0).
Следует обратить внимание на то, что при изучении термодинамических процессов рассчитывается не абсолютное значение энтропии, а её изменение от состояния 1 до состояния 2. При этом не имеет значения начало отсчёта, при котором энтропия равна 0. В термодинамике принято за начало отсчёта принимать нормальные условия (Т = 273.15 К и Р = 101325 Па)
Использование энтропии даёт более полное представление как о термодинамическом процессе в отдельности, так и о совокупности этих процессов (циклах). В отличии от диаграмм p-v, диаграммы T-s дают представление о том, подводится тепло к системе или отводится от неё.
Следует также отметить, что энтропия s не зависят от характера процесса изменения состояния газа, а определяются только начальным и конечным состояниями рабочего тела, т. е. энтропия s действительно является функцией состояния системы.
Рассмотрим вопрос о практическом использовании энтропии для исследования процессов изменения состояния газов.
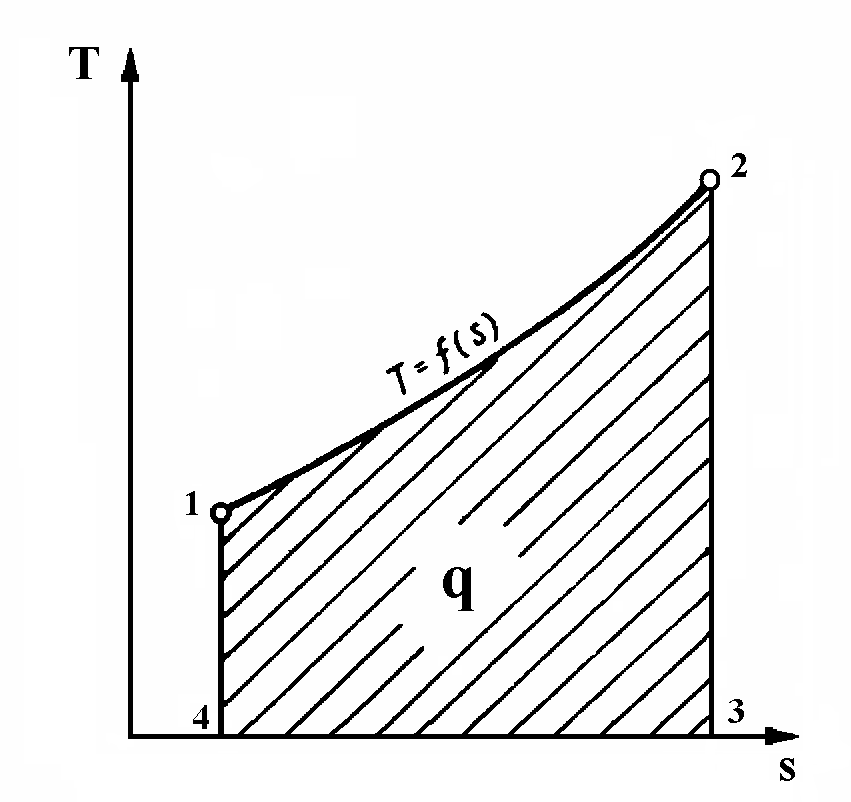
Рис. 10. Т-s диаграмма произвольного процесса.
Рассмотрим процесс в Ts-диаграмме. Площадь, ограниченная кривой процесса 1-2, отрезком оси абсцисс 3-4, двумя крайними ординатами 1-4 и 2-3, соответствует количеству теплоты в этом процессе.
Ранее было отмечено, что если ds > 0, то dq > 0. Соответственно, если ds < 0, то и dq < 0. Таким образом, если в процессе изменения состояния газа энтропия уменьшается (ds < 0), следовательно, теплота отводится от газа и, наоборот, если энтропия возрастает (ds > 0), то это значит, что теплота сообщается газу. При этом количество подведённой или отведённой теплоты графически определяется площадью под кривой процесса в Ts-диаграмме. В этом состоит важнейшее практическое значение энтропии. Понятие об энтропии позволяет упростить, и в то же время сделать более наглядным исследование процесса изменения состояния газа.
 2015-04-01
2015-04-01 2397
2397
