Такой процесс может протекать в цилиндре поршневой машины, если по мере подвода теплоты к рабочему телу поршень машины перемещается, увеличивая объём настолько, что температура рабочего тела остаётся постоянной, или когда система расширяется или сжимается настолько медленно, что температура не изменяется.
1. Термодинамический процесс, протекающий при постоянной температуре называется изотермическим процессом.
2. Основное условие протекания процесса dТ = 0, Т = const
3. Основное уравнение процесса – PV = const.
Откуда вытекает 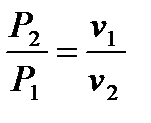
Из представленного выражения видно, что в процессе при постоянной температуре давление газа изменяется обратно пропорционально изменению объёма.
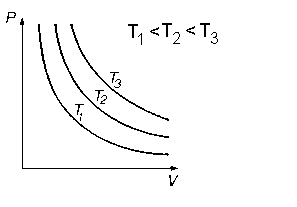
Рис. 6. Изотерма идеального газа при различных температурах.
4. Графиком процесса является гипербола, называемая изотермой.
Из графика видно, что чем выше температура Т, тем выше изотерма располагается на графике.
5. Т.к. процесс идёт при постоянной температуре, то изменения внутренней энергии и энтальпии равны нулю:
|
|
|
du = cv dT = 0, di = cp dT = 0
Исходя из этого, можно отметить, что изотермический процесс идеального газа одновременно является процессом при постоянной внутренней энергии и постоянной энтальпии, т.е. u = const и i = const.
Уравнение первого закона термодинамики для изотермического процесса принимает вид
dq = dl
Из представленного выражения видно, что вся сообщаемая газу теплота в изотермическом процессе идёт на совершение работы расширения.
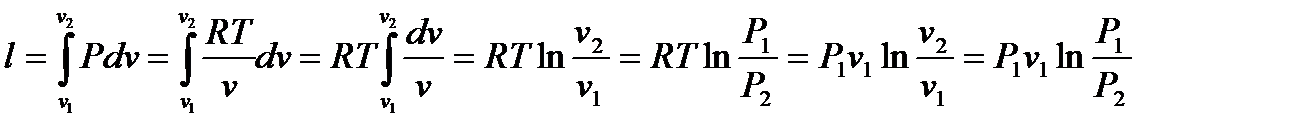
Удельная работа в изотермическом процессе
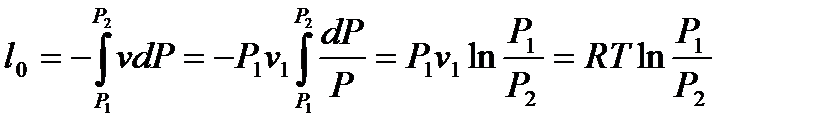
Из представленных уравнений видно, что в изотермическом процессе для идеального газа располагаемая работа равна работе процесса и, в свою очередь, равна теплоте процесса.
Доля теплоты, расходуемая на изменение внутренней энергии в процессе при Т = const,
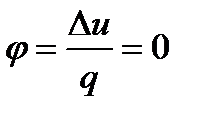
а доля теплоты, расходуемая на выполнение работы,
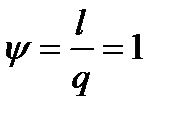
Адиабатные процессы
1. Термодинамический процесс, протекающий без теплообмена с окружающей средой, называется адиабатным. Такой процесс имеет место в теплоизолированной системе. Приближённым к адиабатному можно считать процесс, протекающий настолько быстро, что теплота не успевает перейти в окружающую среду. Примером таких процессов может служить взрыв, резкое (мгновенное) воспламенение газа и т.д.
2. Основное условие процесса q = 0, т.е dq = 0.
3. Основное уравнение процесса определяет уравнение Пуассона:
Pvk = const,
где показатель адиабаты k определяется выражением 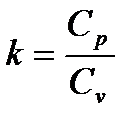
4. Графиком адиабатного процесса является парабола.
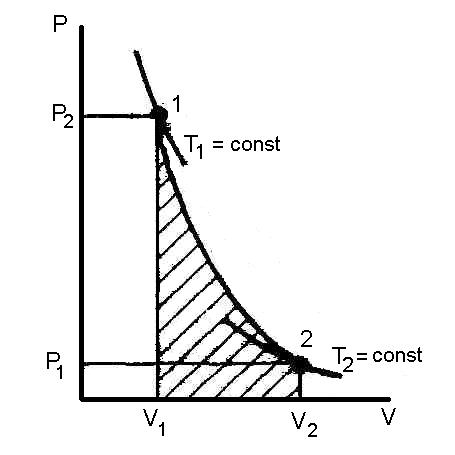
Рис. 7. Адиабата идеального газа.
Из основного уравнения следует:
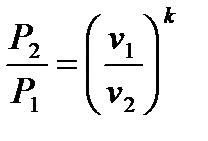
т.е при адиабатическом расширении давление падает, а при сжатии – возрастает.
Представленное уравнение выражает зависимость между давлением и объёмом. Учитывая, что в адиабатном процессе изменяются все три параметра состояния, необходимо выявить зависимость между v и T, а также p и Т.
|
|
|
Зависимость между температурой Т и объёмом v можно получить из уравнений состояний, записанных для точек процесса 1 и 2:
P1v1 = RT1 и P2v2 = RT2, откуда
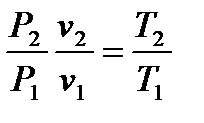
Из этого соотношения можно получить:
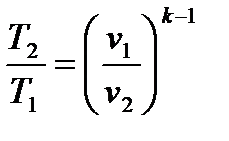 или Тvk-1 = const
или Тvk-1 = const
из представленных уравнений получается
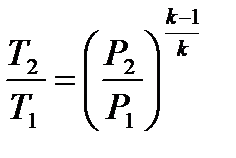 или
или 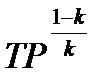
Т.к. dq =0 и q=0, то первый закон термодинамики можно записать:
0 = Du + l или Du = - l
6. Работа расширения в адиабатном процессе совершается за счёт уменьшения внутренней энергии газа и, как следствие, температура газа уменьшается. И наоборот, работа сжатия газа совершается за счёт увеличения внутренней энергии, и температура газа при этом возрастает.
Работу в изотермическом процессе можно представить как
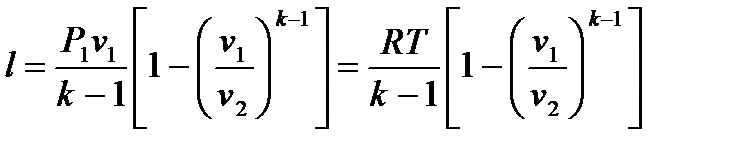
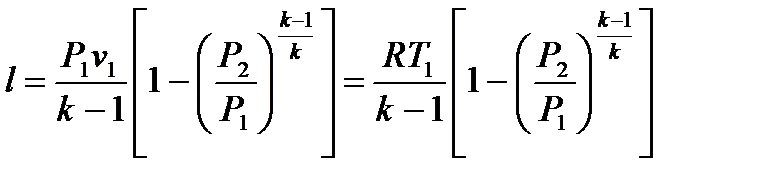
Располагаемая работа вычисляется по формуле
l0 = kl
Из представленного уравнения видно, что располагаемая работа в k раз больше работы технической работы l.
7. g = 0
8., 9. Т.к. g = 0, то нахождение j и y не имеет смысла.
 2015-04-01
2015-04-01 12938
12938








