Исторически энтропия вводилась другим способом. В средине 19 века Клаузиус показал, что существует такая термодинамическая функция, которая является функцией состояния и изменение которой для обратимого изотермического перехода теплоты равно приведенной теплоте процесса.
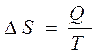 (Дж/моль К) (19)
(Дж/моль К) (19)
Эта величина получила название энтропии.
Обратимые процессы протекают последовательно через ряд состояний равновесия. Для обратимого перехода бесконечно малого количества теплоты предыдущее выражение можно записать в следующем виде:
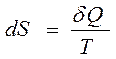 (20)
(20)
dS здесь является полным дифференциалом. Энтропия является функцией состояния, и ее изменение не зависит от пути перехода из начального состояния в конечное.
Обратимся к 1-ому началу термодинамики:
dQ = dU +dА
Разделив это выражение на T, получим для обратимых процессов:
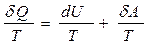
Отсюда, зная что dQ=ТdS, получим
dU =Т·dS - dА (21)
Это уравнение служит аналитическим выражением объединенного первого и второго законов для обратимых процессов.
|
|
|
Если работа производится идеальным газом против внешнего давления, то dАобр = р·dV. При этом предыдущее выражение для объединенного первого и второго закона термодинамики предстанет виде:
dU = Т·dS - р·dV (22)
Так как dU и dS являются полными дифференциалами, то и dАобр = р·dV здесь не зависит от пути.
Изменение энтропии в фазовых переходах DSф.п . можно представить как
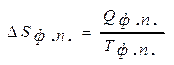
где Q ф.п. и T ф.п. – соответственно теплота и температура фазового перехода.
Изменение энтропии при бесконечно малом изменении температуры вещества можно представить как
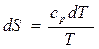
 2015-04-01
2015-04-01 765
765








