Как известно, в клетках ферменты находятся не в растворённой форме, а прикреплены к определённым структурам и локализованы в органеллах. Это связано с тем, что ферменты не стабильные соединения и при воздействии ряда физических и химических факторов могут инактивироваться.
Иммобилизованными ферментами называют ферменты, искусственно связанные с нерастворимым носителем, но сохраняющие свои каталитические свойства.
Иммобилизованные ферменты имеют ряд преимуществ в сравнении со свободными молекулами:
1.Такие ферменты представляют собой гетерогенные катализаторы, легко отделяющиеся от реакционной среды;
2. Могут использоваться многократно;
3.Обеспечивают непрерывность каталитического процесса.
Кроме того, иммобилизация ведёт к изменению свойств фермента:
- Субстрактной специфичности;
- Устойчивости;
- Зависимости активности от параметров среды.
Иммобилизованные ферменты долговечны и в десятки тысяч раз стабильнее свободных энзимов. Так, происходящая при температуре 65°С термоинактивация лактатдегидрогеназы, иммобилизованной в 60%-м полиакриламидном геле, замедлена в 3600 раз по сравнению с нативным ферментом.
|
|
|
Это обеспечивает высокую экономичность, эффективность и конкурентоспособность технологий, использующих иммобилизованные ферменты.
Материалы (носители) для иммобилизации ферментов.
По Дж. Порату (1974), идеальные материалы используемые для иммобилизации ферментов, должны обладать следующими свойствами:
1. Нерастворимостью;
2. Высокой химической и биологической стойкостью;
3. Значительной гидрофильностью;
4. Достаточной проницаемостью как для ферментов, так и для субстратов и продуктов реакции;
5. Способностью носителя легко активироваться.
В зависимости от природы носители делятся на:
1. Органические материалы;
2. Неорганические материалы.
Органические полимерные носители можно разделить на 2 класса: а) природные; б) синтетические. В свою очередь, каждый из классов органических полимерных носителей подразделяется на группы в зависимости от их строения. Среди природных полимеров выделяют: белковые; полисахаридные; липидные носители, а среди синтетических: полиметиленовые; полиамидные; полиэфирные носители.
К преимуществам природных носителей следует отнести: 1. Доступность; 2. Полифункциональность; 3. Гидрофильность, а к недостаткам – высокую стоимость.
Из полисахаридов для иммобилизации наиболее часто используют: целлюлозу, декстран, агарозу и их производные.Для придания химической устойчивости их линейные цепи поперечно сшивают эпихлоргидрином. В полученные сетчатые структуры легко вводят различные ионогенные группировки.
|
|
|
Из природных аминосахаридов в качестве носителей для иммобилизации применяют хитин, который в значительных количествах накапливается в виде отходов в процессе промышленной переработки крабов и креветок. Хитин химически стоек и имеет хорошо выраженную пористую структуру.
Среди белков практическое применение в качестве носителей нашли структурные протеины, такие как: кератин, фиброин, коллаген и продукт переработки коллагена – желатин. Эти белки широко распространены в природе, поэтому доступны в больших количествах, дешёвы и имеют большое число функциональных групп для связывания фермента. Белки способны к биодеградации, что очень важно при конструировании иммобилизованных ферментов для биотехнологических целей.
Синтетические полимерные носители включают полимеры на основе стирола, акриловой кислоты, поливинилового спирта, полиамидные и полиуретановые поли меры. Их преимущество: 1. Механическая прочность; 2. Возможность варьирования в широких пределах величины пор и введения различных функциональных групп. Синтетические полимеры воспроизведены в таких изделиях, как трубы, волокна, гранулы. Все эти свойства полезны для разных способов иммобилизации ферментов.
Носители неорганической природы представляют собой материалы изготовленные из стекла, глины, керамики, графитовой сажи, а также силохромы и оксиды металлов. Их можно подвергать химической модификации, для чего носители покрывают плёнкой оксидов алюминия, титана, циркония. Или обрабатывают органическими полимерами.
Основное преимуществ о неорганическихносителей: лёгкость регенерации. Подобно синтетическим полимерам неорганическим носителям можно придать любую форму и получать их с любой степенью пористости.
Итак, к настоящему времени создано огромное число разнообразных носителей для иммобилизации ферментов. Однако для каждого индивидуального фермента, используемого в конкретном технологическом процессе, необходимо подбирать оптимальные варианты как носителя, так и условий и способов иммобилизации.
Методы иммобилизации ферментов.
Существуют два принципиально различных метода иммобилизации ферментов:
1.Без возникновения ковалентных связей между ферментом и носителем (физические методы иммобилизации);
2.С образованием ковалентной связи между ними (химические методы иммобилизации). Каждый из этих методов осуществляется разными способами (рис. 10.5).
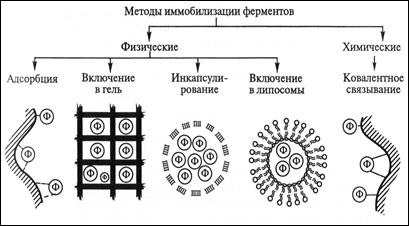
Рис. 10.5. Методы иммобилизации ферментов
Физические методы иммобилизации ферментовреализуются посредством:
1. Адсорбции ферментов на нерастворимых носителях;
2. Путём включения энзимов в поры поперечно сшитого геля;
3. Включение ферментов в полупроницаемые структуры (1. инкапсулирование и 2. включение ферментов в липосомы).
Адсорбция ферментов на нерастворимых носителях. При адсорбционной иммобилизации белковая молекула удерживается на поверхности носителя за счёт электростатических, гидрофобных, дисперсионных взаимодействий и водородных связей.
Адсорбция была первым методом иммобилизации ферментов (Дж. Нельсон, Э. Гриффин, 1916 г), но и сейчас не потеряла своего значения и стала широко распространённым способом получения ферментов в промышленности. В литературе описано получение адсорбционным способом более 70 иммобилизованных ферментов с использованием таких носителей, как кремнезём, активированный уголь, графитовая сажа, различные глины, пористое стекло, полисахариды, синтетические полимеры, оксиды алюминия, титана и других металлов. Последние применяются наиболее часто.
Эффективность адсорбции молекулы белка на носителе определяется пористостью носителя. Процесс адсорбции ферментов на нерастворимых носителях отличается крайней простотой и достигается при контакте водного раствора фермента с носителем при перемешивании. С этой целью раствор фермента смешивают со свежим осадком, например, гидроксида титана, и высушивают в мягких условиях. Активность фермента при таких условиях иммобилизации сохраняется практически на 100%, а удельная концентрация белка достигает 64 мг на 1 г носителя.
|
|
|
К недостаткам адсорбционного метода следует отнести невысокую прочность связывания фермента с носителем. При изменении условий иммобилизации может произойти десорбция фермента, его потеря и загрязнение продуктов. Существенно повысить прочность связывания фермента с носителем может предварительная его модификация (обработка ионами металлов, полимерами, белками, гидрофобными соединениями, монослоем липида).
Иммобилизация ферментов путём включения в гель. Способ иммобилизации ферментов путём включения в трёхмерную структуру полимерного геля широко распространён благодаря своей простоте и уникальности. Метод применим для иммобилизации не только индивидуальных ферментов, но даже отдельных клеток. иммобилизацию ферментов в геле осуществляют двумя способами:
1. Фермент вводят в водный раствор мономера, а затем проводят полимеризацию, в результате которой возникает пространственная структура полимерного геля с включёнными в его ячейки молекулами фермента.
2. Фермент вносят в раствор уже готового полимера, который впоследствии переводят в гелеобразное состояние.
Для первого варианта используют гели: полиакриламида, поливинилового спирта, силикагеля. Для второго: гели крахмала, агар-агара, агарозы, фосфата кальция.
Иммобилизация ферментов в гелях обеспечивает равномерное распределение энзима в объёме носителя. Все гели обладают высокой механической, химической, тепловой и биологической стойкостью и обеспечивает возможность многократного использования фермента, включённого в его структуру.
Иммобилизация ферментов в полупроницаемые структуры
|
|
|
(1.инкапсулирование и 2.включение ферментов в липосомы).
Сущность этих способов иммобилизации заключается в отделении водного раствора фермента от водного раствора субстрата с помощью полупроницаемой мембраны, пропускающей низкомолекулярные молекулы субстратов, но задерживающей большие молекулы фермента. Разработано две модификации этого направления, которых представляют собой микрокапсулирование и включение ферментов в липосомы.
Метод инкапсулирования разработан Т. Чангом в 1974 г. и состоит в том, что водный раствор фермента включается внутрь замкнутой микрокапсулы, стенки которой образованы полупроницаемым полимером. Один из механизмов возникновения мембраны на поверхности водных микрокапсул фермента заключается в реакции межфазной поликонсистенции двух соединений, одно из которых растворено с водой, а другое – в органической фазе. Примером может служить образование на поверхности раздела фаз микрокапсулы, получаемой путём поликонденсации гексаметилендиамина – 1,6 (водная фаза) и гелогенангидрида себациновой кислоты (органическая фаза):
 H2N – (CH2)6 – NH2 + CIOC – (CH2)8 – COCI
H2N – (CH2)6 – NH2 + CIOC – (CH2)8 – COCI
- HCI
 – HN – (CH2)6 – NH – CO – (CH2)8 – CO –
– HN – (CH2)6 – NH – CO – (CH2)8 – CO –
Размер получаемых капсул составляет сотни микрометров, а толщина мембраны - сотые доли микрометра.
Достоинство метода микрокапсулирования – простота, универсальность, возможность многократного использования нативного фермента, поскольку он может быть отделён от непрореагировавшего субстрата процедурой простого фильтрования. Особенно существенно, что методом микрокапсулирования могут быть иммобилизованы не только индивидуальные ферменты, но и целые клетки и отдельные фрагменты клеток. К недостаткам метода следует отнести невозможность инкапсулированных ферментов осуществлять превращения высокомолекулярных субстратов.
Близким к инкапсулированию вариантом иммобилизации является метод включения водных растворов ферментов в липосомы, т. е. двойные липидные (жировые) шарики. Впервые данный метод был применён для иммобилизации ферментов Дж. Вайсманом и Дж. Сессом в 1970 году. Для получения липосом из растворов липида (чаще всего лецитина) упаривают органический растворитель. Оставшуюся тонкую плёнку липидов выдерживают в водном растворе, содержащем фермент. В процессе выдержки происходит самовпитывание (самосборка) липидных структур липосомы, содержащих данный раствор фермента.
Ферменты, иммобилизованные путём включения в структуру липосом, используют преимущественно в медицинских и биотехнологических целях.
Химические методы иммобилизации ферментов. Представляют иммобилизацию ферментов путём образования новых ковалентных связей между ферментом и носителем – наиболее массовый способ получения промышленных биокатализаторов.
В отличие от физических вариантов, эти методы иммобилизации обеспечивают прочную и необратимую связь фермента с носителем и сопровождаются стабилизацией молекулы энзима. Однако расположение фермента относительно носителя на расстоянии одной ковалентной связи создаёт трудности в осуществлении каталитического процесса. Ферменты отделяют от носителя с помощью вставки (сшивка, или спейсер), в роли которой чаще всего выступают полифункциональные агенты бромциан, гидразин, глутаровый диальдегид. В этом случае структура иммобилизованного фермента включает носитель, вставку и фермент, соединённые между собой ковалентными связями.
Принципиально важно, чтобы в иммобилизации фермента участвовали функциональные группы, не существенные для его каталитической функции. Так, гликопротеины обычно присоединяют к носителю через углеводную, а не через белковую часть молекулы фермента.
Более сложной является проблема стабилизации ферментов, поскольку носитель может оказывать сильное влияние на стабильность и активность иммобилизованного фермента. При правильном использовании этого обстоятельства можно одновременно решить и проблему стабилизации фермента к действию температуры и среды, с учетом следующих факторов, приводящих к инактивации ферментов.
1. Как все белки, ферменты могут быть «съедены» микроорганизмами, присутствующими в окружающей среде.
2.Может происходить межмолекулярная агрегация белковых молекул или их гидролиз под собственным воздействием ферментов.
3. Молекула фермента может потерять свою трёхмерную структуру (конформацию) в результате нарушения взаимодействий белковых групп полипептидной цепи под действием теплоты, повышения кислотности среды, органических растворителей. Это приводит к разрушению активного центра фермента и потере его активности.
4. Инактивация может происходить за счёт химической модификации функциональных групп, например вследствие окисления или реакций с примесями.
Все эти последствия устраняются при:
1. Иммобилизации ферментов в пористых носителях, размеры пор которых таковы, что фермент как бы экранирован от действия микробов.
2. Проведение процесса в условиях пастеризации, при температуре 70°С, поскольку в настоящее время разработаны приёмы стабилизации ферментов в условиях повышенных температур, препятствующие воздействию на белковые глобулы.
3. Фермент включают в небольшие для него «тесные» поры носителя. Тогда поры полностью препятствуют межмолекулярным процессам инактивации и разрушению активного центра фермента.
Разработанными приёмами можно достичь стабилизации ферментов в сотни и даже тысячи раз. При помощи такой технологии можно увеличить время жизни ферментов при 60-70°С от нескольких минут до нескольких месяцев, что очень важно для практического их использования.
В настоящее время ведётся интенсивный поиск и культивирование микроорганизмов, живущих в горячих источниках Камчатки при температурах 60-70°С и даже до 110°С, а также выделение из них ферментов.
Иммобилизуют не только выделенные ферменты, но и целые клетки микроорганизмов. Чаще всего их включают в полиакриламидный гель. Использование клеток по сравнению с выделенными ферментами имеет ряд следующих преимуществ:
1. Процесс обходится значительно дешевле;
2.Ферменты в клетках намного стабильнее, чем в выделенном состоянии.
К недостаткам применения клеток относится очень низкая проницаемость клеточных оболочек для субстратов.
Иммобилизация клеток и применение биокаталитических процессов в пищевой промышленности и диагностике.
Наряду с иммобилизацией ферментов в последнее время всё большее внимание уделяется иммобилизации клеток. Это объясняется тем, что при использовании иммобилизованных клеток отпадает необходимость выделения и очистки ферментных препаратов. Создаётся возможность получения пролиферментных систем, осуществляющих многостадийные непрерывно действующие процессы.
В промышленных процессах чаще используют покоящиеся клетки, поскольку все хозяйственно – ценные продукты синтезируются главным образом в стационарной фазе развития клеточных культур. Растущие клетки разрушают структуру носителя. Образующиеся при делении дочерние клетки, покидая носитель, загрязняют целевой продукт. Для подавления роста иммобилизованных клеток растений используют фитогормоны, а рост клеток бактерий тормозят добавлением антибиотиков.
Иммобилизованные клетки микроорганизмов применяют дл биотрансформации органических соединений, гидролиза ряда сложных эфиров, восстановления стероидов.
Разработан биореактор на основе иммобилизованных клеток дрожжей для получения этанола из мелассы, в котором дрожжи сохраняют способность к спиртовому брожению в течение 1800 часов. Из более чем 2000 известных в настоящее время ферментов иммобилизована и используется в производственных условиях примерно десятая часть (оксидоредуктазы, гидролазы и трансферазы).
Для осуществления химических процессов с помощью иммобилизованных ферментов применяют колоночные, трубчатые и танкерные реакторы разного объёма и производительности (рис. 10.6).
Иммобилизованные ферментные системы функционируют в биореакторе в виде неподвижной фазы, через которую протекает среда с субстратом, подлежащим химическому превращению (гетерогенный катализ).
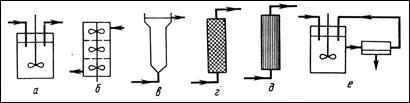
Рис. 10.6. Системы биореакторов для реализации биокатализа
а - биореактор с механическим перемешиванием; б - многоступенчатая система с механическим перемешиванием; в - биокатализ в «кипящем слое», г - биореактор с фиксированным слоем биокатализаторов и с рециркуляцией; д - тубулярные биореакторы (колонны); е - биореактор с контуром ультрафильтрации для отделения продукта
При переработке крахмалосодержащего сырья на спирт для осахаривания раньше использовали солод. Очевидно, средства и технология осахаривания крахмала и являются первыми промышленными устройствами и методами реализации ферментативных процессов.
В ряде случаев добавленный к субстрату фермент после реакции отделить невозможно, например, при обработке мяса или осаждении молочного белка при помощи сычужного фермента в сыроделии. Оборудование и технология в этих случаях специфичны.
Если для биокатализа используют свободные неиммобилизованные ферменты, то применяют биореакторы с мешалкой. В этом случае процесс осуществляется обычно в периодическом или полунепрерывном режиме. Для реализации непрерывного режима со свободными ферментами наиболее эффективны тубулярные биореакторы, в которых может быть установлена насадка. При работе с иммобилизованными ферментами применяют биореакторы различных типов, в том числе с механическими мешалками, одно- и многоступенчатые, колонно-тубулярные, с фиксированным слоем биокатализатора, а также биореакторы «кипящего слоя».
Вообще, если система биокатализа основана на использовании стабильных (иммобилизованных) ферментов, в этом случае наиболее эффективно применение закрытой системы, каковой является биореактор с фиксированными многоразовыми катализаторами (мембраны, волокна, трубки, зернистые структуры). В таких реакторах наряду с непрерывным режимом используется и периодический.
Для эффективного перемешивания и газообмена биореактор снабжают мешалкой. Повреждающее действие мешалки на биокатализатор устраняют, закрепляя определённым образом его гранулы. Например, в биореакторе «сетчатого» типа мешалка вращается в полом цилиндре из сетчатой структуры (корзина), в ячейках которой закреплён иммобилизованный фермент. Во внутреннем объёме трубчатых реакторов рыхло расположены полые волокна, заполненные биокатализатором. Степень превращения субстрата в продукт в таких реакторах достигает 95%.
 2015-04-30
2015-04-30 10842
10842








