В отличие от идеальных, в реальных газах учитываются силы взаимодействия между молекулами и их объем. Из большого числа уравнений, предложенных для описания реальных газов, наиболее простым и вместе с тем дающим достаточно хорошие результаты признано уравнение голландского физика Ван-дер-Ваальса.
Ван-дер-Ваальс ввел две поправки в уравнение Менделеева – Клапейрона, учитывающие собственный объем молекул и силы межмолекулярного взаимодействия.
Из-за действия сил отталкивания молекулы не могут сблизиться на расстояние < d, то есть свободный объем, доступный молекулам одного моля реального газа будет не 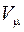 , а
, а 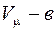 (где в – объем, занимаемый молекулами).
(где в – объем, занимаемый молекулами).
Действие сил притяжения приводит к появлению дополнительного давления на газ, называемого внутренним давлением Р'. По расчетам Ван-дер-Ваальса внутреннее давление определяется как:
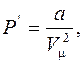 (6.63)
(6.63)
где а – постоянная Ван-дер-Ваальса; 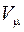 – объем одного моля газа.
– объем одного моля газа.
Вводя приведенные выше поправки в уравнения Менделеева–Клапейрона 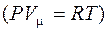 , получим уравнение Ван-дер-Ваальса для одного моля газа:
, получим уравнение Ван-дер-Ваальса для одного моля газа:
|
|
|
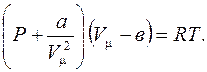 (6.64)
(6.64)
Для произвольной массы газа с учетом того, что 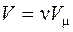 уравнение состояния реального газа (Ван-дер-Ваальса), примет вид:
уравнение состояния реального газа (Ван-дер-Ваальса), примет вид:
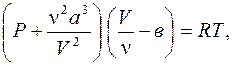 (6.65)
(6.65)
где 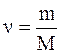 – число молей газа; a и в – поправки Ван-дер-Ваальса, постоянные для каждого газа и определяются опытным путем.
– число молей газа; a и в – поправки Ван-дер-Ваальса, постоянные для каждого газа и определяются опытным путем.
Так как 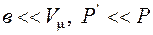 , то при малых давлениях и высоких температурах уравнение Ван-дер-Ваальса совпадает с уравнением Клапейрона – Менделеева.
, то при малых давлениях и высоких температурах уравнение Ван-дер-Ваальса совпадает с уравнением Клапейрона – Менделеева.
 2015-04-20
2015-04-20 691
691







