Среди них, сопровождающихся расстройствами регулирующей, согласованной, координирующей и интегрирующей деятельности целостной нервной системы или ее отделов и звеньев важное значение имеют следующие.
Дефицит процесса торможения в ЦНС. Он, как правило, приводит к патологическому растормаживанию нервных структур, находящихся под контролем тех или иных тормозных структур. Вышедшие из-под тормозного контроля нервные образования активизируются, становятся плохо регулируемыми, их деятельность перестает отвечать потребностям организма, что снижает его приспособительные и гомеотатические возможности. В условиях патологии какого-либо отдела ЦНС, связанного активирующими и/или тормозными влияниями с другими ее отделами, изменяется деятельность этих нервных структур и зависящих от них тех или иных функциональных и физиологических систем организма.
Экспериментальной моделью (синдромом) растормаживания центральных нервных структур является децеребрационная ригидность (рис. 38-1).
|
|
|
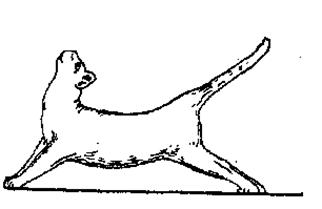
Рис. 38-1 Децеребрационная регидность у кошки
Она возникает в результате выпадения тормозных влияний со стороны надспинномозговых нервных структур, особенно со стороны красных ядер. Данный синдром проявляется резким повышением тонуса мышц-разгибателей. При этом конечности сильно вытянуты, голова запрокинута назад, хвост приподнят. Децеребрационная ригидность развивается в результате преобладания активности вестибуло-спинальной системы, приводящей к тоническим возбуждающим влияниям вестибулярных ядер на спинальные мотонейроны, которые находятся под тормозным контролем со стороны красных ядер, ответственных за активизацию мотонейронов мышц сгибателей. Таким образом, при выпадении тормозных влияний растормаживаются и гиперактивизируются прежде всего те нейроны, которые в норме находятся в состоянии тонического возбуждения.
Данный патологический процесс лежит в основе образования генераторов патологически усиленного возбуждения, патологической доминанты, патологических рефлексов и др.
В качестве примера дефицита процесса возбуждения в ЦНС можно привести возникновение растормаживания различных спинальных центров (половых, мочеиспускания, дефекации) при ослаблении тормозных влияний со стороны коры больших полушарий. Этим можно объяснить сексуальную распущенность, недержание мочи, непроизвольную дефекацию и др.
Денервационный синдром. В результате выпадения нервных (двигательных и вегетативных, эфферентных и афферентных) структур возникает комплекс многообразных изменений в постсинаптических структурах различных регулируемых ими органов и тканей. Биологическое значение этого синдрома заключается в выпадении, снижении или извращении определенных функций, дефектности, инертности регуляции денервированных органов и тканей, нарушении их трофики (характера и интенсивности метаболических процессов), проявляющегося развитием гипо- и дистрофии, а также в повышении чувствительности клеточно-тканевых структур тех или иных органов к нейромедиаторам, гормонам и различным ФАВ.
|
|
|
Деафферентация. В результате выключения афферентации по автономным и соматическим нейронам возникают нарушения, главным образом, чувствительности, а также трофики и даже локомоции (движений) регулируемых ими рабочих органов и тканей. При денервации полной деафферентации обычно не происходит в силу множественности афферентных входов в тело нейрона, а тем более в то или иное ядро ЦНС. Несмотря на это, функции данных нервных структур все же изменяются (обычно повышается возбудимость, нарушаются тормозные механизмы, формируется генератор патологически усиленного возбуждения и др.), а значит, нарушается деятельность и других зависимых от них регуляторных и исполнительных образований. В качестве примеров можно привести следующие: патологическая импульсация из центральной культы перерезанного нерва; появление антигенов в деаферрентированном органе, неадекватные (чаще повышенные) реакции деаферентированного органа на различные ФАВ (гормоны, медиаторы и др.); расстройство генетического аппарата в деафферентированном органе и др.;
Нейродистрофический процесс. Данный процесс возникает в разных органах и тканях, в том числе и в самой нервной системе, в результате выпадения или нарушения различных нервных влияний со стороны афферентных, ассоциативных и эфферентных нейронов (их тел и отростков) как соматической, так и автономной нервной системы. В основе нейродистрофического процесса лежат следующие изменения.
Во-первых, возникают расстройства синтеза, секреции и/или действия нейромедиаторов, комедиаторов (веществ, выделяющихся вместе с нейромедиаторами и играющих роль нейромодуляторов, обеспечивающих регуляцию рецепторных и мембранных эффектов и участвующих в регуляции метаболических процессов), трофогенов (макромолекулярных веществ, главным образом, пептидов, осуществляющих собственно трофические влияния на нервные клетки и иннервируемые ими ткани). Трофогены (трофины, нейротрофические факторы) вырабатываются, главным образом, нейронами (поступают в клетки-мишени, движутся антероградным способом с аксоплазматическим током нейрона), глиальными и шванновскими клетками, а также клетками-мишенями тканей и органов (движутся ретроградным способом). Трофогены могут образовываться из белков крови и клеток иммунной системы. Они обеспечивают не только разнообразные синаптические, но и несинаптические межклеточные взаимодействия, индуцируют трофико-пластические и структурные процессы, дифференцировку, рост, развитие как нейронов, так и различных иннервируемых ими клеточно-тканевых структур.
Во-вторых, могут образовываться патотрофогены (вещества, вырабатывающиеся как в нейронах, так и периферических тканях различных эффекторных структур). Патотрофогены индуцируют устойчивые патологические изменения в регулируемых нейронами исполнительных клеточно-тканевых структурах. Обычно они возникают при значительных, грубых повреждениях не только нейронов, но и регулируемых ими тканей, сопровождающихся нарушениями их структурных, метаболических и физиологических процессов. Нейродистрофический процесс усиливается при возникновении расстройств гемо - и лимфоциркуляции, энергетического и пластического видов обмена и различных трофических нарушений, возникающих как при органических (необратимых) повреждениях разных структур нейронов и нервных центров, так и при функциональных (обратимых) их изменениях (например, при неврозах).
|
|
|
38.7. Патология нейрона
Патология нейрона включает следующие разнообразные по характеру и степени метаболические, структурные и функциональные расстройства различных нейронов соматического и автономного отделов нервной системы.
Нарушения проведения возбуждения по различным структурам нейронов. Они возникают под действием различных экзо - и эндогенных патогенных факторов при травмах, ишемии, энергетическом дефиците, демиемилизации нервных волокон и т.д. Основными механизмами являются изменения мембранного потенциала, генерации и проведения потенциала действия по мембранам нейрона. Проявляются изменением деятельности селективных каналов мембран, их проницаемости для различных ионов (и прежде всего для Na+, K+, Са+2, Cl- и др.), возбудимости мембран и т.д.
Нарушения аксонального (антероградного и ретроградного) транспорта различных регуляторных веществ (медиаторов, комедиаторов, трофогенов, патотрофогенов, ферментов, мономеров, ионов и др.). Последние возникают при нарушениях структуры, метаболизма и функций нейрофиламентов, микротрубочек и других внутриклеточных органелл, а также сократительных белков актина и миозина) Важную роль в их развитии играют дефицит содержания Са+2, мароэргов, витаминов (В1, В6, С, Е и др.).
Патология дендритов. Дендриты, их ветви и шипики являются самыми ранимыми структурами нейронов. Наибольшие расстройства возникают при повреждении шипикового аппарата дендритов, имеющего большое значение во взаимодействии их с дендритами, аксонами и телами других нейронов, в формировании нейрональной памяти и т.д. Этот аппарат страдает при различных видах патологии (гипоксии, ишемии, интоксикациях, травмах, дистрессе).
Нарушения структурного гомеостаза нейронов. Проявляются парциальными или тотальными расстройствами различных структур нейронов (мембран, ядер, органелл, цитоплазмы). Особое место в их развитии занимают повреждения клеточных и внутриклеточных мембран. В генезе последних важную роль играет избыток продуктов ПОЛ, свободных жирных кислот, недоокисленных метаболитов, цитокинов и многих других факторов. В итоге развиваются и прогрессируют различные дегенеративные и дистрофические процессы в нейронах, усиливающиеся при нарушении внутриклеточных регенеративных процессов (синтеза белков, образования мембран, органелл, нервных отростков, рецепторов и др).
|
|
|
Расстройства процессов внутриклеточной сигнализации (как в нейронах, так и в регулируемых ими эффекторных клетках). Возникают в результате нарушения активности усилительных (пусковых) ферментов (аденилатциклазы,гуанилатциклазы, фосфолипазы С и др.) и образующихся под их влиянием вторичных мессенджеров (ц-АМФ, ц-ГМФ, инозиттрифосфата, диацилглицерина), а также изменений содержания универсального внутриклеточного мессенджера Са+2. Все это приводит либо к усилению, либо к торможению активности протеинкиназ, изменяющих фосфорилирование и активность разных функциональных белков.
Расстройства деятельности синапсов и синаптической передачи возбуждения с нейрона на нейрон и на различные эффекторы. При этом могут нарушаться как пре-, так и постсинаптический аппарат. Пресинаптические расстройства возникают в результате изменений: 1) поступления к пресинаптическим терминалям потенциала действия, 2) синтеза, депонирования и распада в них либо тормозных, либо возбуждающих медиаторов, 3) выделения последних в синаптическую щель, 4) образования оксида азота (NO), 5) поступления и действия разных нейромодуляторов, трофогенов, патотрофогенов и других ФАВ, 6) энергетического и пластического обменов и т.д. Постсинаптические расстройства обусловлены изменениями на субсинаптических мембранах, во-первых, количества и/или активности рецепторов, медиаторов, а также комедиаторов, трофогенов, патотрофогенов, гормонов, оксида азота и других ФАВ, во-вторых, ферментов и субстратов, приводящих к нарушениям энергетического и пластического обменов и т.д.
Дефицит энергообеспечения нейронов. Возникает не только из-за нарушения процесса окислительного фосфорилирования в митохондриях и недостатка субстратов окисления (особенно глюкозы) приводящего к снижению образования макроэргов (АТФ, АДФ, креатинфосфата), но из-за расстройств процесса использования этих крайне необходимых для жизнедеятельности нервной ткани энергетических веществ. Потребность же нейронов (особенно коры мозга) в энеогообеспечении самая высокая из всех клеток организма человека.
Дефицит кислородного обеспечения деятельности нейронов. Возникает в результате развития разли
чных видов гипоксии (тканевой, дыхательной, циркуляторной, гемической и др.), особенно при повышении потребности нейронов в кислороде. В силу высокой чувствительности нейронов (особенно коры больших полушарий головного мозга) к гипоксии довольно быстро развиваются нарушения сознания, условных, а также безусловных рефлексов, тромозных механизмов, возникновение в нервных структурах дегенеративно-дистрофических процессов. Интенсивная гипоксия не только сопровождает, но и усиливает многие формы патологии мозга. В тоже время умеренная, незначительная гипоксия может активизировать метаболические процессы в нейронах, повышать их трофический и пластический потенциал, а также их адаптацию, резистентность и работоспособность.
Гибель нейронов. Может быть в виде некроза (острого, остроченного и отдаленного) и апоптоза. Некроз – это глубокая и необратимая дегенерация и деструкция разных по степени зрелости (обычно дифференцированных) нейронов под влиянием патогенных факторов). Апоптоз - это запрограммированная естественная гибель потенциально слабых, как не достигших необходимой дифференцировки нейронов, так и тех, которые стали старыми. Процесс апоптоза находится под контролем системы функционально связанных генов, программирующих как наступление смерти нейронов, так предупреждающих их гибель. Найдены вещества, способные не только ускорять, но и замедлять развитие апоптоза. В частности, к факторам, активирующим апоптоз, относятся танатины, особые патотрофогены, продукты распада сфингомиелина, дефосфорилирующие белки, фосфатазы и др. К факторам, тормозящим апоптоз, относятся некоторые протеинкиназы (протеинкиназа С, тирозинкиназа и др.).
38.8. Расстройства интегративной деятельности
нервной системы
Патологические изменения интегративной деятельности нервной системы возникают вследствие либо органических дефектов в межнейрональных связях тех или иных нервных структур, приводящих к нарушению их нормальных (физиологических) функций, либо формирование новых патологических нервных интеграций, не свойственных нормальной нервной системе. Расстройства интегративной деятельности нервной системы проявляются в следующих разнообразных видах: патологическом рефлексе, патологическом парабиозе, патологической доминанте, генераторе патологически усиленного возбуждения в ЦНС, патологической детерминанте, патологической системе, недостаточности антисистемы, патологии нервной регуляции различных уровней организации организма. Описаны также новые формы дизрегуляционной патологии нервной системы (Г.Н. Крыжановский).
Патологический рефлекс. Это рефлекторная реакция, ограничивающая приспособление организма к изменениям как внешней, так и внутренней среды и имеющая для него отрицательное биологическое значение. Патологические рефлексы могут быть как безусловными, так и условными. Эти рефлексы отличаются прочностью и инертностью. Они могут формироваться на базе защитно-приспособительных рефлексов (рвота, кашель, чихание, понос). Любой рефлекс может стать патологическим, если в той или иной части его рефлекторной дуги или рефлекторного кольца произойдет стойкое изменение, вызванное действием патогенного раздражителя. Условиями возникновения патологических рефлексов являются различные как функциональные так, особенно, органические нарушения различных отделов нервной системы. Патологические рефлексы обычно приводят либо к нарушениям нормальной регуляции, либо к появлению новой патологической формы регуляции (например, рвоты у беременных при раздражении матки).
Патологический парабиоз. Это состояние стойкого (длительного), стационарного, неколеблющегося, локализованного в месте своего возникновения возбуждения, приводящего к нарушению проводимости в той или иной нервной структуре организма и имеющего для него отрицательное биологическое значение. Патологический парабиоз сопровождается частичной или полной утратой способностей нервной структуры к восстановлению нарушенных функций, имеет отрицательное биологическое значение для организма, снижает его приспособительные и резистогенные возможности, а также работоспособность и продолжительность жизни.
Еще Н.Е. Введенским было показано, что в нервно-мышечном препарате при действии на него разнообразных повреждающих факторов развиваются различные функциональные состояния (возбуждение, торможение, смерть). На схеме 38-1 представлены пять наиболее часто встречающихся функциональных состояний возбудимых структур организма.
В отличие от физиологического, для патологического парабиоза характерны неблагоприятные последствия: расстройства функций нервных образований; восстановление функций нерва ограничено, оно частичное, либо его совсем нет; иногда нарушение функций нерва может закончиться его гибелью; снижение приспособляемости, резистентности и гомеостазиса как нервных, так и других структур целостного организма. В то же время патологический парабиоз имеет те же фазы, что и физиологический парабиоз (уравнительную, парадоксальную, наркотическую, тормозную и ультрапарадоксальную).
Патологическая доминанта. Это главенствующий очаг стойкого возбуждения в определённом отделе ЦНС, ослабляющий активность соседних нервных центров путем “притягивания” к себе импульсов, адресованных последним. В результате этого возникают значительные и даже необратимые изменения, ограничиваются приспособительные возможности организма, снижается его резистентность и гомеостазис, а восстановление нарушенных его
 2015-04-30
2015-04-30 1772
1772








