Лабораторная работа №5
Цель работы: изучение химических свойств сурьмы и висмута, в том числе: свойства их производных, свойства их солей и тиосоединений.
Опыт 1.
Из солянокислого раствора хлорида сурьмы (III) при помощи минимального количества щелочи получили осадок нерастворимого гидроксида. Щелочь нужна в небольшом количестве, т.к. полученный гидроксид амфотерен и в избытке щёлочи будет растворяться.
SbCl3 + 3NaOH = Sb(OH)3 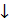 + 3NaCl
+ 3NaCl
Sb3+ + 3OH- = Sb(OH)3 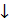
Полученный осадок проверили на растворимость в кислоте и в щелочи. Раствориение произошло в обоих случаях:
Sb(OH)3 + 3NaOH = Na3[Sb(OH)6]
Sb(OH)3 + 3OH- =[Sb(OH)6]3-
Sb(OH)3 + 3HCl = SbCl3 + 3H2O
Sb(OH)3 + 3H+ = Sb3+ + 3H2O
Проделали то же самое с хлоридом висмута (III). Получившийся осадок в щелочи не растворяется.
BiCl3 + 3NaOH = Bi(OH)3 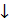 + 3NaCl
+ 3NaCl
Bi3+ + 3OH- = Bi(OH)3 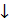
Bi(OH)3 + 3HCl = BiCl3 + 3H2O
Bi(OH)3 + 3H+ = Bi3+ + 3H2O
Bi(OH)3 + 3NaOH – реакция не идёт.
Вывод. Исследовав кислотно-основные свойства испытуемых веществ, установили, что сурьма проявляет амфотерные свойства, в то время как висмут исключительно основные.
Опыт 2.
В концентрированный раствор хлорида сурьмы (III) по каплям добавляли дистиллированную воду до выпадения белого осадка:
SbCl3 + H2O 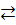 Sb(OH)Cl2 + HCl
Sb(OH)Cl2 + HCl
Sb(OH)Cl2 + H2O 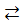 Sb(OH)2Cl + HCl
Sb(OH)2Cl + HCl
 Sb(OH)2Cl
Sb(OH)2Cl 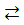 SbOCl
SbOCl 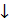 + H2O
+ H2O
Sb3+ + H2O 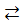 SbOCl
SbOCl  + 2H+
+ 2H+
Либо иногда этот процесс рассматривают как:
[SbCl4]- + H2O 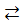 SbOCl
SbOCl  + 2H+ + 3Cl-
+ 2H+ + 3Cl-
Полученный осадок растворим в концентрированной соляной кислоте:
SbOCl 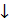 + 2HCl
+ 2HCl 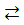 SbCl3 + H2O
SbCl3 + H2O
SbCl3 + HCl 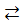 H[SbCl4]
H[SbCl4]
Что вызвано обратным смещением равновесия избытком ионов водорода.
Вывод. При растворении соли сурьмы в воде происходит её ступенчатый гидролиз, а затем отщепление молекулы воды с образованием соли антимонила (стибила) SbO+. Этот процесс обратим.
 2015-05-10
2015-05-10 9292
9292







