Через раствор хлорида висмута пропустили ток сероводорода. При этом выпал осадок коричнево-чёрного сульфида.
2BiCl3 + 3H2S = Bi2S3 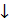 + 6HCl
+ 6HCl
2Bi3+ + 3S2- = Bi2S3 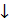
В сульфиде аммония этот осадок не растворяется, следовательно, тиосолей висмут не образует. Это объясняется тем, что исходя из своего положения в ПСХЭ висмут - типичный металл, не склонный к образованию анионов, в то время как сурьма – амфотерный элемент (металлоид). Из вышесказанного следует, что сульфид висмута должен растворяться в концентрированных сильных кислотах, что и наблюдается на деле:
Bi2S3+ 6HCl(конц) = 2BiCl3 + 3H2S (обратный процесс)
Bi2S3 + 6H+ = 2Bi3+ + 3H2S
Вывод. Висмут – типичный металл, не образующий тиосолей. С сероводородом образует нерастворимый в воде сульфид, который легко растворяется в концентрированной соляной кислоте по обменному механизму.
 2015-05-10
2015-05-10 4204
4204








