В.П. Панов
ЗАЩИТЫ ОКРУЖАЮЩЕЙ СРЕДЫ
Часть 2
Учебное пособие
Санкт-Петербург
УДК 628.31
ББК 20.1
Пан 16
Рецензенты:
Доктор технических наук, профессор
А.И. Алексеев,
СЗТУ
Доктор технических наук, профессор
А.В. Панин
СПГУПС
| Пан 16 | Панов В.П. Теоретические основы защиты окружающей среды: Учеб. пособие. Часть 2. – СПб.: СПГУТД, 2003. – 100 с. |
В учебном пособии изложены теоретические основы обезвреживания промышленных сточных вод и выбросов методами адсорбции, абсорбции, ионного обмена, экстракции, фильтрования, пылеулавливания.
Предназначается для студентов, обучающихся по направлению 656600 – «Защита окружающей среды» по курсу «Теоретические основы защиты окружающей среды». Может быть полезно для аспирантов, инженеров, преподавателей, работающих в области защиты окружающей среды.
Утверждено редакционно-издательским советом университета.
УДК 628.31
ББК 20.1
| Ó Санкт-Петербургский государственный университет технологии и дизайна, 2003 Ó Панов В.П., 2003 |
Содержание
| ВВЕДЕНИЕ | |
| 1 АДСОРБЦИОННАЯ ОЧИСТКА СТОЧНЫХ ВОД И ПРОМЫШЛЕННЫХ ВЫБРОСОВ.................. | |
| 1.1 Изотермы адсорбции в системах газообразный (жидкий) адсорбтив-твердый адсорбент............. | |
| 1.2 Теория мономолекулярной адсорбции........... | |
| 1.3 Теория полимолекулярной адсорбции............ | |
| 1.4. Теория объемного заполнения микропор......... | |
| 1.5 Избирательность адсорбции.................... | |
| 1.6 Основные виды пористых адсорбентов........... | |
| 1.7 Кинетика адсорбции.......................... | |
| 1.8 Динамика адсорбции.......................... | |
| 2 АДСОРБЦИОННО-КАТАЛИТИЧЕСКАЯ ОЧИСТКА ПРОМЫШЛЕННЫХ ВЫБРОСОВ................. | |
| 2.1 Физико-химические основы адсорбционно-каталитической очистки газовых сред.............. | |
| 2.2 Кинетические закономерности адсорбционно-каталитических процессов........................ | |
| 2.3 Основы технологического оформления процессов | |
| 3 ИОНООБМЕННАЯ ОЧИСТКА СТОЧНЫХ ВОД (ИО- НООБМЕННАЯ АДСОРБЦИЯ).................... | |
| 3.1 Иониты, основные характеристики.............. | |
| 3.2 Равновесие ионного обмена.................... | |
| 3.3 Механизм и кинетика процессов ионного обмена.. | |
| 3.4 Умягчение воды методом катионного обмена..... | |
| 4 АБСОРБЦИОННАЯ ОЧИСТКА ГАЗОВЫХ ВЫБРОСОВ | |
| 4.1 Равновесие в системах газ-жидкость............. | |
| 4.2 Материальный и тепловой балансы абсорбции.... | |
| 4.3 Кинетика абсорбции.......................... | |
| 4.4 Кинетика абсорбции, сопровождаемой химической реакцией....................................... | |
| 4.5 Абсорбционные методы санитарной очистки газов. |
| 5 ЭКСТРАКЦИОННЫЕ МЕТОДЫ ОЧИСТКИ СТОЧ- НЫХ ВОД...................................... | |
| 5.1 Экстрагирующая способность растворителей..... | |
| 5.2 Кинетика экстракции.......................... | |
| 5.3 Принципиальные схемы экстракции............. | |
| 6 ОЧИСТКА ГАЗОВ ОТ ТВЕРДЫХ (ЖИДКИХ) ЗА- ГРЯЗНЕНИЙ.................................... | |
| 6.1 Дисперсный состав и свойства пыли............. | |
| 6.2 Сухое гравитационное и инерционное пылеулавливание.......................................... | |
| 6.3 Физические основы очистки газов от пыли фильтрованием....................................... | |
| Литература........................................ |
ВВЕДЕНИЕ
В современном мире экологические проблемы по своей значимости вышли на первое место среди других проблем. Научные и технические достижения XX века породили опасную для будущего человечества концепцию о господстве над силами природы. Бурное развитие хозяйственной деятельности человека приводит к интенсивному, часто разрушительному воздействию на окружающую среду. Влияние человека на природу происходит, в том числе, и в результате загрязнения почв, вод, воздуха. На современном этапе развития техники и технологии необходимы грамотные специалисты по инженерной защите окружающей среды от антропогенных загрязнений, способные решать вопросы предотвращения загрязнения почв, воды и воздуха промышленными сбросами и выбросами.
Данное учебное пособие является продолжением учебного пособия "Теоретические основы защиты окружающей среды. Выделение примесей сточных вод. Часть 1". В нем изложены теоретические основы методов очистки сточных вод и выхлопных газов, основанных не только на выделении примесей, но и на их превращениях. Рассмотрены физико-химические и технологические основы осуществления адсорбционных процессов (закономерности поглощения примесей из сточных вод и отходящих производственных газов на твердых адсорбентах и жидкими абсорбентами, ионообменной адсорбцией), а также развивающихся методов адсорбционно-каталитического обезвреживания выхлопных газов. Данные методы широко используются в промышленности для решения экологических проблем.
В меньшей степени распространены методы экстракционной очистки сточных вод, но они могут быть полезны при регенерации отработанных растворов и организации рециклов технологических потоков. Определенное внимание уделено основам процессов очистки газов от твердых и жидких взвешенных примесей, главным образом методам фильтрования.
В учебном пособии предпринята первая попытка систематизации опыта преподавания данного курса в СПГУТД для студентов специальности 330200 "Инженерная защита окружающей среды" при отсутствии учебников по данной дисциплине. Автор будет признателен коллегам за конструктивные замечания и пожелания, направленные на совершенствование преподавания данной дисциплины.
Автор выражает искреннюю признательность сотрудникам кафедры "Инженерная химия и промышленная экология" СПГУТД, а также профессорам А.И. Алексееву и А.В. Панину за ценные советы и рекомендации, способствовавшие улучшению рукописи.
1 АДСОРБЦИОННАЯ ОЧИСТКА СТОЧНЫХ ВОД
И ПРОМЫШЛЕННЫХ ВЫБРОСОВ
Так как атомы или молекулы жидкости или твердого тела, находящиеся на поверхности, обладают большей энергией, чем атом или молекула внутри конденсированных фаз, то поверхностную энергию рассматривают как избыток энергии, приходящейся на единицу поверхности. Увеличение поверхности приводит к росту числа поверхностных молекул или атомов в системе и сопровождается затратой работы на разрыв межмолекулярных связей. Отсюда следует, что уменьшение поверхности, т.е. обратный процесс, должен протекать самопроизвольно, так как происходит уменьшение энергии Гиббса поверхностного слоя.
Уменьшение поверхности тел может происходить за счет снижения поверхностного натяжения. Мелко раздробленные твердые или жидкие тела, обладающие избытком поверхностной энергии, стремясь уменьшить ее, самопроизвольно агрегируют. К явлениям, происходящим вследствие стремления к самопроизвольному снижению поверхностного натяжения, относится адсорбция.
Адсорбция – процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемной фазой. Она происходит в многокомпонентных системах, причем в поверхностный слой предпочтительнее переходят те компоненты, которые сильнее уменьшают межфазное натяжение. Адсорбция может быть и результатом химического взаимодействия компонентов с веществами на поверхности поглотителя – хемосорбция. При хемосорбции поверхностная энергия может даже возрастать при одновременном уменьшении энергии всей системы.
Более плотную фазу, определяющую форму поверхности, принято называть адсорбентом, хотя адсорбция происходит на границе раздела фаз. Адсорбент может быть жидким или твердым. Перераспределяемое вещество, обычно находящееся в объеме жидкой или газообразной фазы, называют адсорбтивом, а после его поглощения адсорбентом – адсорбатом. Обратный процесс перехода вещества из поверхностного слоя в объемную фазу называют десорбцией.
В зависимости от агрегатного состояния смежных фаз различают адсорбцию газов на твердых адсорбентах, адсорбцию растворенных веществ на границах твердое тело-жид-кость и жидкость-жидкость, а также адсорбцию на границе раствор-газ, называемую абсорбцией.
Физическая адсорбция вызывается силами молекулярного взаимодействия, в частности дисперсионными силами. Молекула любого адсорбтива обладает флуктуирующими диполями, вызывающими "мгновенные" отклонения распределения электронной плотности от среднего распределения. При сближении молекул адсорбтива с атомами или молекулами адсорбента движение флуктуирующих диполей приобретает упорядоченный характер, обусловливающий взаимное притяжение. В ряде случаев дисперсионные силы слагаются с электростатическими силами – ориентационными и индукционными. Ориентационные силы возникают при взаимодействии полярных молекул с поверхностью, содержащей электростатические заряды, а индукционные – вызываются изменением электронной структуры молекул адсорбтива и адсорбента под действием друг друга. Взаимодействие, вызываемое электростатическими силами, зависит от химической природы реагентов и является специфическим. Вклад специфического взаимодействия в общую энергию процесса на электронейтральных адсорбентах приближается к нулю, а при адсорбции полярных молекул на адсорбентах с гетероионным характером соизмерим с вкладом неспецифической составляющей.
В отличие от физической адсорбции при хемосорбции не сохраняется индивидуальность адсорбтива (адсорбата) и адсорбента. При сближении молекул адсорбтива с поверхностью происходит перераспределение электронов взаимодействующих молекул с образованием химической связи. Если физическую адсорбцию можно сравнить с конденсацией, то хемосорбцию можно рассматривать как химическую реакцию на поверхности раздела фаз. Физическую и химическую адсорбцию различают по теплоте адсорбции: при физической адсорбции она не превышает 80..120 кДж/моль, а при хемосорбции может достигать нескольких сотен кДж/моль. Кроме того, хемосорбция может протекать при высоких температурах, тогда как физическая адсорбция в таких условиях пренебрежимо мала. При хемосорбции молекулы адсорбата не могут перемещаться по поверхности адсорбента, их положение фиксировано, и такую адсорбцию называют локализованной, а физическая адсорбция может быть и нелокализованной.
Для количественного описания адсорбции используют в основном две величины: гиббсовскую адсорбцию Г – определяется избытком вещества в поверхностном слое по сравнению с его количеством в таком же объеме фазы, отнесенном к единице поверхности. Более часто используют в практических расчетах величину адсорбции, измеряемую количеством или массой адсорбата, приходящегося на единицу площади поверхности или на единицу массы адсорбента в твердом состоянии. Эту величину называют или адсорбционной способностью, или величиной адсорбции, или адсорбируемостью. Для газов адсорбцию характеризуют величиной объема газа, поглощенного единицей массы адсорбента.
Физический смысл величин адсорбции Аi и гиббсовской адсорбции Гi и различие между ними выражает уравнение
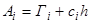 , (1.1)
, (1.1)
где сi – концентрация адсорбата в объеме; h – толщина поверхностного слоя.
Так как объем и толщина поверхностного слоя экспериментально практически не определяются, то данное уравнение не используется для определения адсорбции. Для расчета величин гиббсовской адсорбции используют соотношение
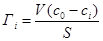 , (1.2)
, (1.2)
где V – общий объем системы; c 0 – исходная концентрация компонента; сi – концентрация компонента в фазе после адсорбции; S – площадь поверхности адсорбента.
Величина гиббсовской адсорбции может быть меньше нуля, если 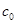 < сi, в противоположность величине адсорбции Аi, которая не может быть отрицательной. Если концентрация адсорбата в поверхностном слое значительно больше, чем в объеме и Аi примерно равна Гi, то для определения Аi используют уравнение (1.2).
< сi, в противоположность величине адсорбции Аi, которая не может быть отрицательной. Если концентрация адсорбата в поверхностном слое значительно больше, чем в объеме и Аi примерно равна Гi, то для определения Аi используют уравнение (1.2).
Количество адсорбированного вещества в поверхностном слое при равновесии находится в определенной зависимости от концентрации (или парциального давления) компонента в объеме и от температуры. Уравнение состояния адсорбционной системы имеет следующий вид:
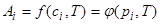 , (1.3)
, (1.3)
где сi и рi – соответственно равновесная концентрация и парциальное давление адсорбтива; Т – температура.
Из последнего соотношения следует, что возможны три вида зависимости величины адсорбции от параметров системы. Зависимость величины адсорбции от концентрации (парциального давления) при постоянной температуре называют изотермой адсорбции:
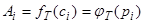 . (1.4)
. (1.4)
Зависимость величины адсорбции от температуры при постоянной концентрации (парциальном давлении) вещества называют изопикной (изобарой) адсорбции:
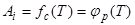 . (1.5)
. (1.5)
Реже используют величину изостеры адсорбции, т.е. зависимость концентрации (парциального давления) вещества в объеме от температуры при постоянной величине адсорбции:
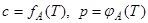 . (1.6)
. (1.6)
В экспериментальных исследованиях наиболее часто используют изотермы адсорбции, так как обеспечить постоянство температуры при исследовании закономерностей процессов значительно проще.
1.1 Изотермы адсорбции в системах газообразный
(жидкий) адсорбтив-твердый адсорбент
В качестве характеристики адсорбционных свойств твердых тел используют изотермы адсорбции, которые при всех условиях (наличие других веществ, различная кинетика процесса) являются основной характеристикой адсорбентов и определяют выбор условий проведения процессов. Совокупность изотерм адсорбции является источником информации о структуре адсорбентов, тепловом эффекте процессов и др.
Следует отметить, что твердые адсорбенты, как правило, имеют поры разного размера. В зависимости от размера поры подразделяются на три типа: микро-, мезо- и макропоры. Микропоры – наиболее мелкие поры с размерами, соизмеримыми с размерами адсорбируемых молекул, их эффективные радиусы находятся в интервале 0,5..1,5 нм. Суммарный объем микропор промышленных адсорбентов не превышает 0,5 см3/г.
Размеры мезопор лежат в интервале 1,5..200 нм. Стенки таких больших пор образованы очень большим числом атомов или молекул вещества адсорбента. Для мезопор действие адсорбционных сил характерно не во всем объеме, а практически на небольшом расстоянии от стенок. Если для микропор характеристика "удельная поверхность" не имеет физического смысла, так как адсорбция в микропорах сводится к заполнению объема микропор, то для мезопористых сорбентов важна удельная поверхность адсорбента. Удельная поверхность может изменяться для таких адсорбентов от 10 до 400 м2/г.
 Макропоры – самые крупные поры адсорбентов, их эффективные радиусы превышают 200 нм, а удельная поверхность всего 0,5..2 м2/г.
Макропоры – самые крупные поры адсорбентов, их эффективные радиусы превышают 200 нм, а удельная поверхность всего 0,5..2 м2/г.
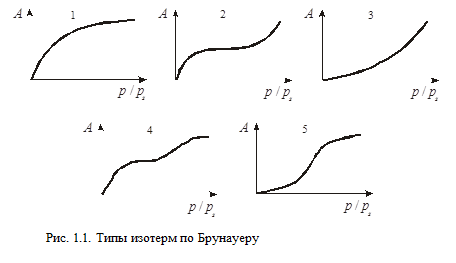
Брунауером выделены пять основных типов изотерм адсорбции в системах газ-твердое (рис. 1.1). Первый тип изотерм характерен для микропористых адсорбентов, практически не содержащих мезопор. Безусловно, это не однозначно.
Начальные выпуклые участки изотерм 2 и 4 (рис. 1.1) также связаны с наличием микропор в адсорбенте, но это преимущественно мезо- и макропористые сорбенты. Дальнейший ход кривых определяется полимолекулярной адсорбцией или капиллярной конденсацией. Начальные вогнутые участки изотерм 3 и 5, сравнительно редко встречающихся, характерны для систем адсорбат-адсорбент, когда взаимодействие молекул адсорбата и адсорбента меньше межмолекулярного взаимодействия молекул адсорбата.
Основное отличие изотерм 2 и 3 типов от изотерм 4 и 5 типов состоит в том, что объем мезопор адсорбентов (4 и 5) заполняется адсорбатом в результате капиллярной конденсации раньше, чем концентрация (или относительное давление р / рs) приблизится к 1. На изотермах 4 и 5 появляется верхний, почти горизонтальный участок.
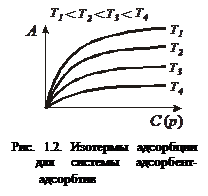 В основе расчета любого технологического процесса лежит совокупность кривых, отражающих равновесие поглощаемого компонента с адсорбентом. Совокупность изотерм адсорбции определяет в широком интервале изменения температуры, условия проведения как адсорбции, так и десорбции (рис. 1.2).
В основе расчета любого технологического процесса лежит совокупность кривых, отражающих равновесие поглощаемого компонента с адсорбентом. Совокупность изотерм адсорбции определяет в широком интервале изменения температуры, условия проведения как адсорбции, так и десорбции (рис. 1.2).
В результате адсорбции происходит перераспределение компонентов между объемом фазы и поверхностным слоем, что влечет за собой изменение их химических потенциалов в системе. Поэтому адсорбцию иногда рассматривают как процесс превращения поверхностной энергии в химическую. Для разбавленных растворов неэлектролитов фундаментальное адсорбционное уравнение Гиббса имеет вид:
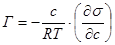 , (1.7)
, (1.7)
где 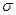 – поверхностное натяжение или удельная поверхностная энергия.
– поверхностное натяжение или удельная поверхностная энергия.
В разбавленных растворах, когда концентрация адсорбтива стремится к нулю, производная в скобках будет постоянной величиной, а величина адсорбции – пропорциональна концентрации (активности) адсорбтива.
Если адсорбция происходит из газовой фазы, то, выразив концентрацию через парциальное давление, получим:
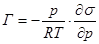 . (1.8)
. (1.8)
Зная зависимость поверхностного натяжения раствора от концентрации (давления пара) растворенного вещества, по уравнениям (1.7) и (1.8) можно рассчитать изотерму адсорбции компонента. Единица гиббсовской адсорбции не зависит от единиц измерения концентрации (давления) в объемной фазе, а зависит от того, в каких единицах выражена газовая постоянная R. Так как R относится к молю вещества, а поверхностное натяжение – к единице площади, то и гиббсовская адсорбция всегда выражается в молях на единицу площади. Если 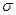 выражается в Дж/м2, то необходимо принять R = 8,3144 Дж/(моль × К), чтобы привести в соответствие все единицы измерения.
выражается в Дж/м2, то необходимо принять R = 8,3144 Дж/(моль × К), чтобы привести в соответствие все единицы измерения.
 2015-05-13
2015-05-13 920
920








