Большое число адсорбционных систем описывается изотермами второго типа. Для таких изотерм характерен резкий подъем при относительном давлении (р / рs) более 0,2, связанный, как считают, с образованием второго и последующих слоев молекул, покрывающих молекулы первого слоя адсорбата. Согласно Брунауеру, Эммету и Теллеру поведение каждого адсорбированного слоя в отдельности соответствует концепции Ленгмюра. В состоянии равновесия скорость конденсации молекул на чистой поверхности равна скорости испарения из первого слоя. Аналогичное равенство справедливо для скорости конденсации на каждом предшествующем и скорости испарения в данном слое. Последнее допущение связано с характером сил, действующих между адсорбционными слоями. Ими принято, что эти действующие силы подобны ван-дер-ваальсовым силам, обусловливающим конденсацию, а значит теплота адсорбции во всех слоях, кроме первого, равна теплоте конденсации.
Уравнение полимолекулярной адсорбции, носящее название уравнения БЭТ, имеет вид (вывод его приведен в учебниках по коллоидной химии и монографиях):
|
|
|
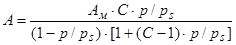 . (1.14)
. (1.14)
Для пористых адсорбентов уравнение БЭТ достаточно хорошо описывает поглощение газов в интервале относительных давлений от 0,05 до 0,35. По данному уравнению также определяют удельную поверхность адсорбентов.
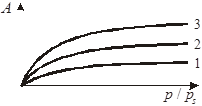
Величины адсорбции индивидуальных веществ зависят от размеров пор адсорбента. Влияние размера пор показано на рис.1.4.
Для обработки экспериментальных данных используют уравнение БЭТ в линейной форме:
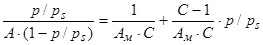 .
.
Константы уравнения Ам и С находят из наклона прямых 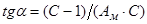 и отрезков, отсекаемых прямыми на оси ординат (
и отрезков, отсекаемых прямыми на оси ординат (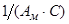 ), построенных в координатах уравнения БЭТ (рис. 1.5).
), построенных в координатах уравнения БЭТ (рис. 1.5).
| 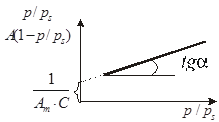
|
| Рис. 1.4. Изотермы адсорбции ин- дивидуального вещества на различных образцах адсор- бентов: 1 – крупнопористый; 2 – среднепористый; 3 – мел- копористый | Рис. 1.5. Изотермы полимолекуляр- ной адсорбции индивидуально- го вещества в координатах ли- нейной формы уравнения БЭТ |
Константа С непосредственно связана с чистой мольной теплотой адсорбции, соответствующей разности теплоты адсорбции в первом слое Q 1 и мольной теплоты конденсации пара адсорбтива 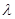 :
:
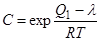 . (1.16)
. (1.16)
Уравнение (1.16) используют для вычисления значения чистой теплоты адсорбции из экспериментальных данных. Величина константы С определяет вид изотерм: при С менее 2 изотерма имеет вогнутую форму (третий тип), а при С более 2 вид изотермы соответствует S-образной кривой (второй тип изотерм).
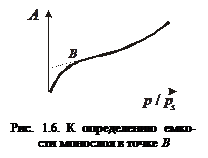 Для последнего типа изотерм оценка удельной поверхности адсорбента может быть проведена по точке В – точке перегиба на изотерме (рис. 1.6), свидетельствующей об окончании заполнения монослоя. При пологих изотермах такой метод может привести к значительным погрешностям определения.
Для последнего типа изотерм оценка удельной поверхности адсорбента может быть проведена по точке В – точке перегиба на изотерме (рис. 1.6), свидетельствующей об окончании заполнения монослоя. При пологих изотермах такой метод может привести к значительным погрешностям определения.
|
|
|
Обычно при измерении удельной поверхности адсорбента в качестве адсорбтива используют азот, а опыты проводят при –196 оС. Величина площадки молекулы азота практически на всех твердых телах составляет 0,162 нм2, причем плотность упаковки молекул в адсорбированном слое соответствует упаковке в нормальной жидкости.
С помощью уравнения БЭТ можно проводить определение удельной поверхности только макро - и мезопористых адсорбентов, а также смешанных типов. Наличие в адсорбенте микропор, объемно заполняющихся молекулами адсорбата, приводит к искажению полученных результатов.
В рассмотренных теориях моно- и полимолекулярной адсорбции было принято допущение об отсутствии взаимодействия между молекулами адсорбата. Однако в некоторых случаях силы взаимодействия могут быть значительны, например, при адсорбции высокомолекулярных органических веществ на полярных адсорбентах. Для подобных процессов предложен ряд уравнений, наиболее простым из которых является уравнение Киселёва:
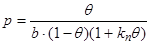 , (1.17)
, (1.17)
где kп – константа, учитывающая взаимодействие адсорбат-адсорбент; b – константа уравнения Ленгмюра; 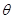 – часть поверхности, покрытая молекулами адсорбата.
– часть поверхности, покрытая молекулами адсорбата.
Уравнение Киселева описывает локализованную адсорбцию на однородной поверхности в области заполнения поверхности первым слоем молекул.
 В мезопорах промышленных адсорбентов при высоких относительных давлениях фазовый переход происходит по механизму капиллярной конденсации. Адсорбция паров в этом случае описывается изотермами, имеющими вид, представленный на рис 1.7. Для таких изотерм характерно наличие петли гистерезиса: при данном относительном давлении точки изотерм, полученные при последовательном понижении давления (т.е. при десорбции), лежат выше точек, полученных при повышении давления (т.е. при адсорбции). Перегиб на изотермах рассматриваемого типа, сопровождающийся расхождением ветвей гистерезиса, начинается при относительных давлениях р / рs = 0,2..0,5. Координата точки перегиба зависит и от вида адсорбента, и от типа адсорбтива.
В мезопорах промышленных адсорбентов при высоких относительных давлениях фазовый переход происходит по механизму капиллярной конденсации. Адсорбция паров в этом случае описывается изотермами, имеющими вид, представленный на рис 1.7. Для таких изотерм характерно наличие петли гистерезиса: при данном относительном давлении точки изотерм, полученные при последовательном понижении давления (т.е. при десорбции), лежат выше точек, полученных при повышении давления (т.е. при адсорбции). Перегиб на изотермах рассматриваемого типа, сопровождающийся расхождением ветвей гистерезиса, начинается при относительных давлениях р / рs = 0,2..0,5. Координата точки перегиба зависит и от вида адсорбента, и от типа адсорбтива.
До этой точки адсорбционная способность растет в результате полимолекулярной адсорбции. После этого адсорбция вещества происходит в результате конденсации пара в мезопорах – капиллярах, смачиваемых адсорбатом. В капиллярах смачивающая жидкость образует вогнутый мениск. Давление пара над вогнутым мениском меньше давления пара над плоской поверхностью, вследствие этого конденсация пара происходит при р / рs < 1. При относительном давлении, равном единице, мезопоры полностью заняты адсорбатом.
Явление гистерезиса, проявляющееся в несовпадении адсорбционной и десорбционной ветвей, объясняют различием в формах мениска при заполнении и опорожнении пор. Десорбция в большинстве случаев происходит с образованием сферического мениска. При адсорбции крупных молекул в относительно мелких порах весь объем пор может быть заполнен еще в процессе собственно адсорбции. Тогда капиллярная конденсация не наступает.
 2015-05-13
2015-05-13 1475
1475








