Значительное число гетерополярных химических соединений под действием полярных растворителей, среди которых наиболее характерным является вода, испытывают кардинальную структурно-энергетическую перестройку при растворении. Поляризующее взаимодействие растворителя приводит к диссоциации растворенного вещества на сольватированные заряженные фрагменты, которые называют ионами. В физике такие образования называют квазичастицами с эффективными массами и размерами, иногда значительно отличающимися от исходных «голых» частиц. Их принципиальная роль в описании конденсированных фаз заключается в том, что они включают в себя значительную часть энергетики их образования. Это упрощает описание, сводя систему преобразованных частиц-ионов к почти идеальной системе, с достаточно слабым межионным взаимодействием.
При таком подходе выделяется роль растворителя, который, сыграв активную роль в образовании ионов, превращается в фоновую среду.
Сильные электролиты − 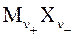 при растворении практически полностью диссоциируют на ν + число положительных (
при растворении практически полностью диссоциируют на ν + число положительных (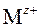 ) и ν − число отрицательных (
) и ν − число отрицательных (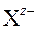 ) ионов согласно уравнению реакции диссоциации (ионизации):
) ионов согласно уравнению реакции диссоциации (ионизации):
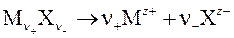 (заряды ионов z + > 0, z − < 0). (4.4)
(заряды ионов z + > 0, z − < 0). (4.4)
Пример: CaCl2 → Ca2+ + 2Cl ¯ (z + = 2, z − = -1).
Если m – моляльность растворенного вещества (электролита), то моляльности положительных и отрицательных ионов: m+ = ν +m, m− = ν − m.
Применим льюисовское определение химического потенциала компонента к неидеальной системе ν = ν ++ ν− взаимодействующих ионов
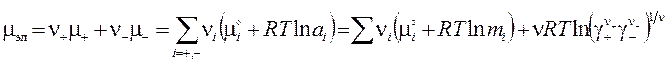 ,
,
где коэффициенты активности γ+ и γ− соответствуют моляльностям. Ввиду невозможности их отдельного определения используется среднеионный коэффициент активности: 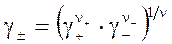 , (4.5)
, (4.5)
а химический потенциал электролита приобретает вид:
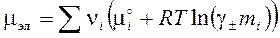 , (4.6)
, (4.6)
Физически обоснованный результат статистической теории Дебая-Хюккеля для разбавленных растворов (без вывода) известен под названием предельного закона. 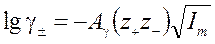 , (4.7)
, (4.7)
где 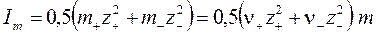 - ионная сила;
- ионная сила;
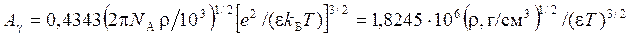
- коэффициент A γ(Т)кроме физических постоянных (числа Авогадро и постоянной Больцмана) включает в себя: ε – относительную диэлектрическую проницаемость (78,54 (H2O)); ρ – плотность раствора, г/см3 (для разбавленного раствора при 25о С ρH2O = 0,997 г/см3).
Значения A γ для ряда растворителей при 25oC равны:0,51 (H2O); 1,778 (СH3OH); 3,7613 (ацетон).
Несмотря на ограниченную концентрационную область применимости (≤ 0,01М) теория Дебая-Хюккеля имеет большое теоретическое значение, поскольку эмпирически установленная зависимость lg γ±от I 1/2 получила обоснование с позиции статистической физики.
Выводы:
1. γ ± → 1 при m → 0, т.е. при значительном разбавлении γ ± можно считать равным 1, а раствор становится идеальным.
2. Стандартные энтальпии и энтропии образования ионов содержатся в  и составляют важнейшую справочную информацию.
и составляют важнейшую справочную информацию.
 2015-05-26
2015-05-26 410
410








