В насыщенных растворах устанавливается равновесие между раствором и не растворившимся осадком
K k A а = k K+ + а A−, 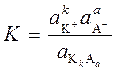
Объединение постоянной для индивидуальной твердой фазы активности 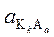 вместе с константой гетерогенного равновесия K носит название произведения растворимости ПР.
вместе с константой гетерогенного равновесия K носит название произведения растворимости ПР.
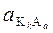 · K ≡ ПР =
· K ≡ ПР = 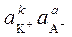
В разбавленных растворах активности можно заменить концентрациями:
ПР = [K+] k ∙[A−] a.
Для сульфида свинца растворимость s = [S2-] = [Pb2+] определяется концентрацией ионов S2- или Pb2+
ПРPbS = [Pb2+] [S2-] = s 2, s = 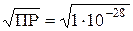 = 10 -14 моль/л.
= 10 -14 моль/л.
Расчет растворимости сульфида висмута по значению ПР:
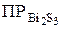 = [Bi3+]2 [S2-]3 = (2 s)2· (3 s)3 = 108 s 5 s = (ПР/108)1/5.
= [Bi3+]2 [S2-]3 = (2 s)2· (3 s)3 = 108 s 5 s = (ПР/108)1/5.
ПР как производное ТЗДМ применимо к ионам в составе сложных смесей. При большом избытке ионов одного вида равновесное значение другого в растворе уменьшается, а потому он переходит в осадок.
Попытаемся растворить CaSO4 в 1М растворе Na2SO4. Растворимость индивидуального CaSO4, совпадающая с содержанием ионов Ca2+: 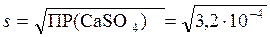 = 1,8·10-2 М. Добавление небольшого количества CaSO4, практически не меняющего концентрацию ионов SO42- в 1М растворе Na2SO4, приводит к тому, что добавляемая порция ионов Ca2+ не может превысить: [Ca2+] = ПР(CaSO4) / [SO42-] = 3,2 · 10-4 / 1 = 3,2 · 10-4. Растворимость оказалась подавленной в 56 раз. На практике H2S используют для высаживания сульфидов металлов; HCl используют для очистки NaCl при выделении его из раствора и т.д.
= 1,8·10-2 М. Добавление небольшого количества CaSO4, практически не меняющего концентрацию ионов SO42- в 1М растворе Na2SO4, приводит к тому, что добавляемая порция ионов Ca2+ не может превысить: [Ca2+] = ПР(CaSO4) / [SO42-] = 3,2 · 10-4 / 1 = 3,2 · 10-4. Растворимость оказалась подавленной в 56 раз. На практике H2S используют для высаживания сульфидов металлов; HCl используют для очистки NaCl при выделении его из раствора и т.д.
 2015-05-26
2015-05-26 560
560








