Экспериментально установлено, что передача пары электронов от NADH на О2 сопровождается образованием по крайней мере трех молекул АТР, т. е. коэффициент фосфорилирования Р/О = 3. Такое же значение коэффициента фосфорилирования следует из величин перепадов свободной энергии между различными группами переносчиков (см. табл. 4.1). Таких перепадов, достаточных для синтеза молекулы АТР, по крайней мере три: между NADH и FeSN2 в комплексе I (≈50 кДж), между убихиноном и цитохромом с 1 в комплексе III (≈13 кДж) и, наконец, между цитохромом а ~ СuA и О2 (≈84 кДж). Причем если окисляется сукцинат с использованием FAD, то отсутствует первый пункт фосфорилирования и при переносе 2е- образуются лишь две молекулы АТР.
По поводу механизма окислительного фосфорилирования существуют три теории: химическая, механохимическая (кон-формационная) и хемиосмотическая.
Химическая и механохимическая гипотезы сопряжения. Согласно химической гипотезе в митохондриях имеются интермедиаторы белковой природы (X, Y, Z), образующие комплексы с соответствующими восстановленными переносчиками. В результате окисления переносчика в комплексе возникает высокоэнергетическая связь. При распаде комплекса к интермедиатору с высокоэнергетической связью присоединяется неорганический фосфат, который затем передается на ADP:
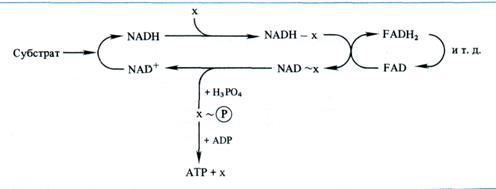
Однако, несмотря на упорные поиски, не удалось выделить или как-то иначе доказать реальное существование постулированных высокоэнергетических интермедиаторов типа X ~  . Гипотеза химического сопряжения не объясняет, почему окислительное фосфорилирование обнаруживается только в препаратах митохондрий с ненарушенными мембранами. И, наконец, с позиций этой гипотезы не находит объяснения способность митохондрий подкислять внешнюю среду и изменять свой объем в зависимости от степени их энергизации.
. Гипотеза химического сопряжения не объясняет, почему окислительное фосфорилирование обнаруживается только в препаратах митохондрий с ненарушенными мембранами. И, наконец, с позиций этой гипотезы не находит объяснения способность митохондрий подкислять внешнюю среду и изменять свой объем в зависимости от степени их энергизации.
Способность митохондриальных мембран к конформацион-ным изменениям и связь этих изменений со степенью энергизации митохондрий послужила основой для создания механо- химических гипотез образования АТР в ходе окислительного фосфорилирования. Согласно этим гипотезам энергия, высвобождающаяся в процессе переноса электронов, непосредственно используется для перевода белков внутренней мембраны митохондрий в новое, богатое энергией конформационное состояние, приводящее к образованию АТР. Одна из гипотез подобного рода, выдвинутая американским биохимиком П. Д. Бойером (1965), может быть представлена в виде следующей схемы:

Автор предположил, что запасание энергии происходит путем конформационных изменений ферментов ЭТЦ аналогично тому, как это наблюдается в белках мышц. Актомиозиновый комплекс сокращается, гидролизуя АТР. Если сокращение белкового комплекса достигается за счет другой формы энергии (за счет окисления), то расслабление, возможно, будет сопровождаться синтезом АТР.
Таким образом, согласно механохимическим гипотезам, энергия окисления превращается сначала в механическую энергию, а затем в энергию высокоэнергетической связи АТР. Однако, подобно химической теории сопряжения, механохимические гипотезы также не могут объяснить подкисление митохондриями окружающей среды.
Хемиосмотическая теория сопряжения. В настоящее время наибольшим признанием пользуется хемиосмотическая теория английского биохимика П. Митчелла (1961). Он высказал предположение, что поток электронов через систему молекул-переносчиков сопровождается транспортом ионов Н+ через внутреннюю мембрану митохондрий. В результате на мембране создается электрохимический потенциал ионов Н+, включающий химический, или осмотический, градиент (ΔрН) и электрический градиент (мембранный потенциал). Согласно хемио-смотической теории электрохимический трансмембранный потенциал ионов Н+ и является источником энергии для синтеза АТР за счет обращения транспорта ионов Н+ через протонный канал мембранной Н+ -АТРазы.
Теория Митчелла исходит из того, что переносчики перешнуровывают мембрану, чередуясь таким образом, что в одну сторону возможен перенос и электронов, и протонов, а в обратную — только электронов. В результате ионы Н+ накапливаются на одной стороне мембраны.
На рис. 4.7 показано, как функционирует ЭТЦ митохондрий в соответствии с хемиосмотической теорией. Между двумя сторонами внутренней митохондриальной мембраны в результате направленного движения протонов против концентрационного градиента возникает электрохимический потенциал. Энергия, запасенная таким образом, используется для синтеза АТР как результат разрядки мембраны при обратном (по концентрационному градиенту) транспорте протонов через АТРазу, которая работает в этом случае как АТР-синтетаза.
За прошедший период хемиосмотическая гипотеза Митчелла получила целый ряд экспериментальных подтверждений. Одним из доказательств роли протонного градиента в образовании АТР при окислительном фосфорилировании может служить разобщающее действие на этот процесс некоторых веществ. Известно, что 2,4-динитрофенол (2,4-ДНФ) подавляет синтез АТР, но стимулирует транспорт электронов (поглощение О2), т. е. разобщает дыхание (окисление) и фосфорилирование. Митчелл предположил, что такое действие 2,4-ДНФ связано с тем, что он переносит протоны через мембрану (т. е. является протонофором) и поэтому разряжает ее. Это предположение полностью подтвердилось. Оказалось, что разные по своей химической природе вещества, разобщающие окисление и фосфорилирование, сходны в том, что, во-первых, они растворимы в липидной фазе мембраны, а, во-вторых, это слабые кислоты, т. е. легко приобретают и теряют протон в зависимости от рН среды. В. П. Скулачев на искусственных фосфо- липидных мембранах показал, что чем легче вещество переносит протоны через мембрану, тем сильнее разобщает эти процессы. Другое экспериментальное подтверждение роли протонного градиента в фосфорилировании было получено Митчеллом, который сообщил о синтезе АТР в митохондриях в результате замены щелочной инкубационной среды на кислую (т. е. в условиях искусственно созданного трансмембранного градиента ионов Н+).
В 1973 г. Э. Рэкеру (США) удалось получить липосомы (везикулы из фосфолипидов), в которые была встроена АТРаза, выделенная из митохондрий сердца быка, и хромопротеин галофильной бактерии Hulobacterium halobium — бактериоро-допсин, обусловливающий создание протонного градиента за счет энергии света. Фосфолипиды для реконструкции мембран этих липосом были выделены из растений (соевые бобы). Полученные таким образом гибридные пузырьки на свету осуществляли фосфорилирование.
Механизм синтеза АТР. Сопряжение диффузии протонов назад через внутреннюю мембрану митохондрии с синтезом АТР осуществляется с помощью АТРазного комплекса, получившего название фактора сопряжения Ft. На электронно-микроскопических снимках эти факторы выглядят глобулярными образованиями грибовидной формы на внутренней мембране митохондрий, причем их «головки» выступают в матрикс (см. рис. 4.7). F1 — водорастворимый белок, состоящий из 9 субъединиц пяти различных типов. Белок F1 представляет собой АТРазу и связан с мембраной через другой белковый комплекс F0, который перешнуровывает мембрану. F0 не проявляет каталитической активности, а служит каналом для транспорта ионов Н+ через мембрану к F1.
Механизм синтеза АТР в комплексе F1 —F0 до конца не выяснен. На этот счет имеется ряд гипотез.
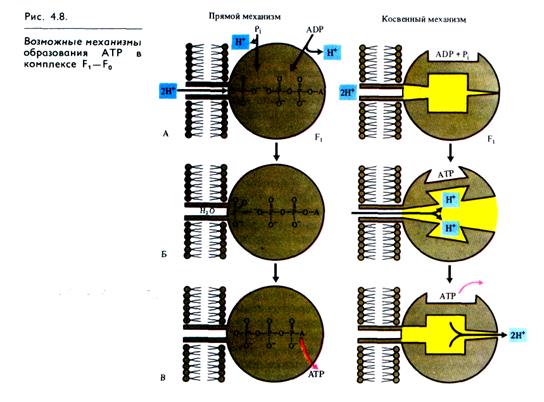
Одна из гипотез, объясняющих образование АТР посред ством так называемого прямого механизма, была предложена Митчеллом (рис. 4.8). По этой схеме на первом этапе фосфо-рилирования фосфатный ион и ADP связываются с F1 -компонентом ферментного комплекса (А). Протоны перемещаются через канал в F0-компоненте и соединяются в фосфате с одним из атомов кислорода, который удаляется в виде молекулы воды (Б). Атом кислорода ADP соединяется с атомом фосфора, образуя АТР, после чего молекула АТР отделяется от фермента (В).
| 4.4 Эндогенны механизмы регуляции дыхания у растений |
Для косвенного механизма возможны различные варианты. Один из них показан на рис. 4.8. ADP и неорганический фосфат присоединяются к активному центру фермента без притока свободной энергии. Ионы Н+, перемещаясь по протонному каналу по градиенту своего электрохимического потенциала, связываются в определенных участках F1 вызывая конформационные изменения фермента (П. Бойер), в результате чего из ADP и Р1 синтезируется АТР. Выход протонов в матрикс сопровождается возвратом АТР-синтетазного комплекса в исходное кон-формационное состояние и освобождением АТР.
В энергизованном виде F1 функционирует как АТР-синте-таза. При отсутствии сопряжения между электрохимическим потенциалом ионов Н+ и синтезом АТР энергия, освобождающаяся в результате обратного транспорта ионов Н+ в мат рикс, может превращаться в теплоту. Иногда это приносит пользу, так как повышение температуры в клетках активирует работу ферментов.
Регуляция процессов дыхания осуществляется на разных уровнях. Прежде всего это субстратный контроль дыхания: доступность, количество и состав дыхательных субстратов. Регуляция активности оксидоредуктаз взаимосвязанных дыхательных циклов, ЭТЦ митохондрий, других оксидаз и оксиге-наз, локализованных в цитоплазме и органоидах, обеспечивается конкуренцией за общие метаболиты и действием соединений, выступающих в качестве аллостерических факторов. АТР и ADP, NADH и NAD+, интермедиаты циклов через системы обратных связей подавляют (отрицательная обратная связь) или активируют (положительная обратная связь) отдельные звенья дыхательного процесса.
На активность ферментов сильно влияют физико-химические условия в клетке (сдвиги рН, состава и концентрации ионов и др.). Фитогормоны действуют на дыхательные процессы через активацию или ингибирование функциональной активности клеток или синтеза белков. Синтез определенных оксидоредуктаз находится под контролем генома и происходит в соответствии с функциональным состоянием клеток и программой развития.
| 4.4.1 Разнообразие путей переноса электронов и ПРОТОНОВ |
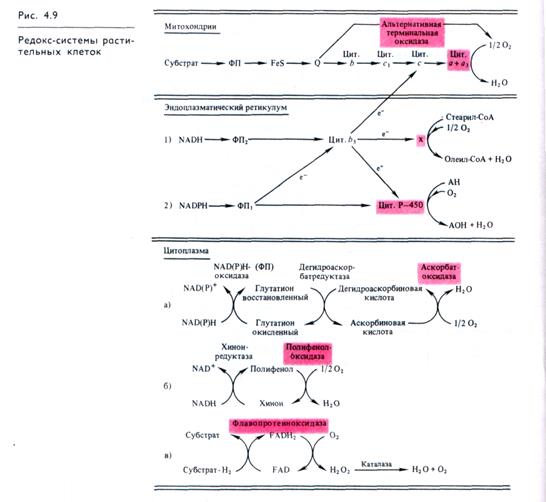
Завершающий этап многих процессов окисления состоит в переносе электронов на кислород, катализируемом терминальными оксидазами. Оксидазные системы такого рода локализованы в митохондриях, в ЭР, плазмалемме, в цитоплазме (цитозоле) клетки (рис. 4.9).
Основная редокс-система клетки — дыхательная цепь — функционирует во внутренней мембране митохондрий. Ее терминальной оксидазой является цитохро-моксидаза. Перенос е~ по редокс-цепи сопровождается освобождением энергии, запасаемой в высокоэнергетических связях АТР.
В растительных митохондриях функционирует еще одна конечная оксидаза, называемая альтернативной терминальной (рис. 4.9). Она получает электроны от коэнзима Q и ее функционирование не сопряжено с запасанием энергии. Деятельностью этой системы объясняется более слабая чувствительность дыхания растительных митохондрий к действию цианида, чем у животных. О природе альтернативной оксидазы известно немного. Чувствительность ее к О2 несколько ниже, чем у цитохромоксидазы, но достаточно высока; активность подавляется рядом хелатирующих соединений (комплексооб-разователей), а также различными замещенными гидроксамо-выми кислотами, например салицилгидроксамовой. Она не является цитохромом b, флавопротеином или FeS-белком. Предполагается, что ее функцию выполняет особый фонд (пул) хинонов, способных к самоокислению. Функции альтернативного (цианидустойчивого) дыхания неясны. Этот путь активируется в условиях высокого содержания АТР в клетке и в случаях, когда снижается активность основной дыхательной
ЭТЦ, что способствует окислению NADH. В початках ароидных эта система участвует в термогенезе, обеспечивая повышение температуры в тканях при цветении на 10 — 20 °С по сравнению с температурой воздуха.
В цитоплазме клетки функционируют системы, окисляющие восстановленные пиридиннуклеотиды с участием в качестве завершающих медьсодержащих оксидаз: аскорбатокси-дазы (рис. 4.9, а) и полифенолоксидазы (рис. 4.9,6). Деятельность аскорбатоксидазы существенна для функционирования таких важных восстановителей в клетках, как глутатион и NAD(P)H. Эта система — главный восстановитель глутатиона. Аскорбатоксидазная активность обнаруживается также в клеточных стенках растительных клеток, однако функции фермента в клеточной стенке не выяснены.
Полифенолоксидаза окисляет о-дифенолы, п-дифенолы, монофенолы и др. Окисление фенолов сопряжено с окислением NAD(P)H или аскорбиновой кислоты. Полифенолоксидаза участвует в «раневой реакции» у растений. При поранении растительных тканей этот фермент превращает освобождающиеся фенолы в хиноны, токсичные для микроорганизмов, что противодействует инфекции. Вследствие этой реакции появляется коричневая окраска на срезах клубня картофеля, яблока и других тканей. Полифенолоксидаза участвует в превращениях предшественников при синтезе лигнина (вместе с перокси-дазой). Ее активность возрастает в период старения тканей.
В цитоплазме присутствуют также флавопротеиновые оксидазы (рис. 4.9, в), окисляющие различные субстраты (см. 4.2.1).
Рассмотренные группы конечных оксидаз — цитохромокси-даза, Полифенолоксидаза, аскорбатоксидаза и флавопротеиновые оксидазы — по-разному реагируют на изменение парциального давления кислорода (табл. 4.2) и температуру окружающей среды. Цитохромоксидаза, обладая высоким сродством к О2, практически не зависит от парциального давления кислорода, продолжая активно функционировать при низких его значениях. Но на ее деятельность сильно влияет температура (Q10 = 4 — 6). Флавопротеиновые оксидазы с более низким сродством к О2 меньше зависят от температуры (Q10 ≈ 2). Полифенолоксидаза и аскорбатоксидаза по этим показателям занимают промежуточное положение.
При окислениях, катализируемых цитоплазматическими оксидазами, АТР не образуется (см. табл. 4.2).
Таблица 4.2 Некоторые свойства терминальных оксидаз (по Bidwell, 1979)
| л | S | |||
| н | X | |||
| Фермент | Сродство к кислороду | женнос тезом | Витель- к-циа | Витель к СО |
| На. о ^Н | И*? о >> | о н£§ | ||
| U о< | т я ч | У х | ||
| Цитохромоксидаза Очень высокое + + + + | ||||
| Альтернативная оксидаза Высокое — — — | ||||
| Полифенолоксидаза Среднее — + + | ||||
| Аскорбатоксидаза Низкое — + — | ||||
| Гликолатоксидаза Очень низкое — — — |
 Помимо оксидаз, в растительных клетках функционируют и различные оксигеназы (см. 4.2.1). В мембранах ЭР локализованы две редокс-цепи. В одной из них при окислении NADH с участием флавопротеина и цитохрома b5 (рис. 4.9, 1) осуществляется оксигеназная реакция, связанная с гидроксили-рованием, приводящая к образованию ненасыщенных связей в жирных кислотах (десатурация). В животных тканях показана возможность взаимодействия этой цепи с редокс-цепью митохондрий. В этом случае электроны от цитохрома b5 передаются на цитохром с дыхательной цепи митохондрий и завершающей оксидазой будет Цитохромоксидаза. Во второй редокс-цепи ЭР (рис. 4.9,2) субстратом является NADPH, а завершает цепь цитохром Р-450, который, используя О2, гидроксилирует многие соединения. Эта редокс-цепь важна для синтеза ряда метаболитов, детоксикации вредных для клетки соединений, теряющих свою активность при гидроксилирова-нии, и для превращения нерастворимых в воде соединений в водорастворимые.
Помимо оксидаз, в растительных клетках функционируют и различные оксигеназы (см. 4.2.1). В мембранах ЭР локализованы две редокс-цепи. В одной из них при окислении NADH с участием флавопротеина и цитохрома b5 (рис. 4.9, 1) осуществляется оксигеназная реакция, связанная с гидроксили-рованием, приводящая к образованию ненасыщенных связей в жирных кислотах (десатурация). В животных тканях показана возможность взаимодействия этой цепи с редокс-цепью митохондрий. В этом случае электроны от цитохрома b5 передаются на цитохром с дыхательной цепи митохондрий и завершающей оксидазой будет Цитохромоксидаза. Во второй редокс-цепи ЭР (рис. 4.9,2) субстратом является NADPH, а завершает цепь цитохром Р-450, который, используя О2, гидроксилирует многие соединения. Эта редокс-цепь важна для синтеза ряда метаболитов, детоксикации вредных для клетки соединений, теряющих свою активность при гидроксилирова-нии, и для превращения нерастворимых в воде соединений в водорастворимые.
1 В качестве основного субстрата дыхания растения исполь- 1 зуют углеводы — наиболее распространенные и важные в энер гетическом отношении соединения, причем в первую очередь окисляются свободные сахара. Если растения испыты вают в них недостаток, субстратами окисления могут быть запасные полимерные вещества — полисахариды и белки, а так же жиры, но лишь после их гидролиза. Поли- и дисахариды гидролизуются до моносахаридов, жиры — до глицерина и жирных кислот, белки — до аминокислот (рис. 4.10).
Функцию запасных углеводов у растений выполняют крахмал (картофель, кукуруза, рис), инулин (георгины, топинамбур), гемицеллюлозы. Микроорганизмы и некоторые высшие растения окисляют многоатомные спирты, образующиеся при восстановлении гексоз. Например, маннит используется на дыхание накапливающих его растений (заразиха, плоды маслины, побеги ясеня), сорбит служит субстратом дыхания хранящихся плодов груш и т. д. Субстратами дыхания могут быть также кислоты первичного окисления Сахаров.
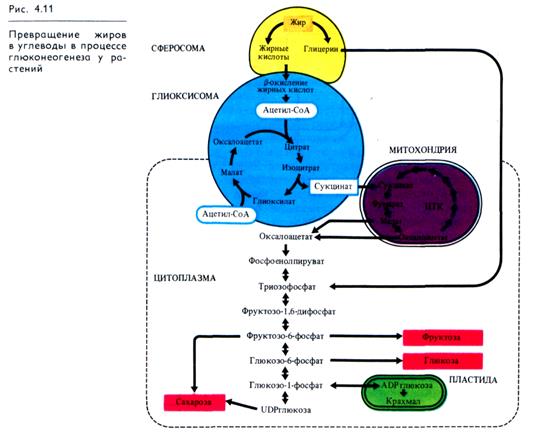
Запасные жиры расходуются на дыхание проростков, развивающихся из семян, богатых жирами (подсолнечник, лен, конопля, клещевина и др.). Использование жиров начинается с их гидролитического расщепления липазой на глицерин и жирные кислоты, что происходит в органоидах, называемых сферосомами — жировыми каплями, или олеосомами (рис. 4.11). Благодаря фосфорилированию и последующему окислению глицерин превращается в фосфотриозу — фосфоглицериновый альдегид, который включается в основной путь обмена углеводов.
 Жирные кислоты окисляются по механизму р-окисления, в результате которого от жирной кислоты последовательно отщепляются двууглеродные ацетильные остатки в форме ацетил-СоА. Процесс (3-окисления жирных кислот протекает в глиоксисомах, где, кроме того, локализованы ферменты глиоксилатного цикла. Ацетил-СоА включается в реакции глиоксилатного цикла, конечный продукт которого — сукцинат (см. 4.2.4) — покидает глиоксисому и в митохондриях участвует в цикле Кребса. Синтезированный в ЦТК малат в цитоплазме при участии малатдегидрогеназы превращается в оксалоацетат, который с помощью ФЕП-карбоксикиназы дает фосфоенолпи-руват (см. 4.2.2). Фосфоглицериновый альдегид и ФЕП служат исходным материалом для синтеза глюкозы (а также фруктозы и сахарозы) в обращенных реакциях гликолиза (рис. 4.11). Процесс образования глюкозы из неуглеводных предшественников получил название глюконеогенеза. Экспериментально показано, что по мере расходования жиров в прорастающих семенах увеличивается содержание Сахаров. При этом в процессе синтеза Сахаров из запасных жиров в растительных клетках взаимодействуют сферосомы, глиоксисомы, митохондрии, пластиды и ферментные системы цитоплазмы (цитозоля).
Жирные кислоты окисляются по механизму р-окисления, в результате которого от жирной кислоты последовательно отщепляются двууглеродные ацетильные остатки в форме ацетил-СоА. Процесс (3-окисления жирных кислот протекает в глиоксисомах, где, кроме того, локализованы ферменты глиоксилатного цикла. Ацетил-СоА включается в реакции глиоксилатного цикла, конечный продукт которого — сукцинат (см. 4.2.4) — покидает глиоксисому и в митохондриях участвует в цикле Кребса. Синтезированный в ЦТК малат в цитоплазме при участии малатдегидрогеназы превращается в оксалоацетат, который с помощью ФЕП-карбоксикиназы дает фосфоенолпи-руват (см. 4.2.2). Фосфоглицериновый альдегид и ФЕП служат исходным материалом для синтеза глюкозы (а также фруктозы и сахарозы) в обращенных реакциях гликолиза (рис. 4.11). Процесс образования глюкозы из неуглеводных предшественников получил название глюконеогенеза. Экспериментально показано, что по мере расходования жиров в прорастающих семенах увеличивается содержание Сахаров. При этом в процессе синтеза Сахаров из запасных жиров в растительных клетках взаимодействуют сферосомы, глиоксисомы, митохондрии, пластиды и ферментные системы цитоплазмы (цитозоля).
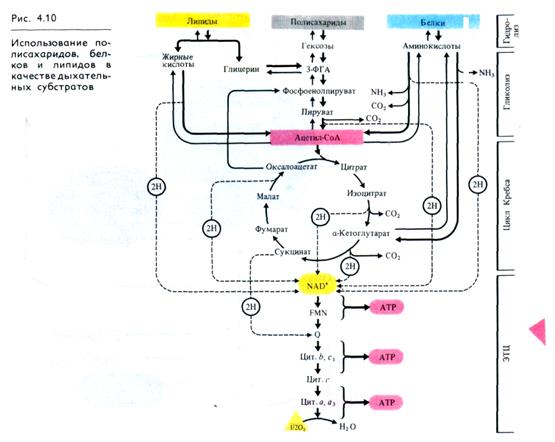
Запасные белки используются для дыхания в результате гидролиза до аминокислот и последующей их окислительной деградации до ацетил-СоА или кетокислот, которые поступают затем в цикл Кребса (см. рис. 4.10).
Полное окисление всех рассмотренных субстратов осуществляется до СО2 и воды с освобождением энергии окисляемых веществ. Причем при гидролизе биополимеров до мономеров освобождается около 1% энергии, гликолиз позволяет получить 1/5 энергии Сахаров; окисление органических кислот до СО2 и Н2О в цикле Кребса и ЭТЦ реализует 4/5 энергии, содержащейся в исходной молекуле дыхательного субстрата.
Отношение количества молей выделяемого при дыхании СО2 к количеству молей поглощенного О2 называется дыхательным коэффициентом (ДК). Для гексоз он равен единице:
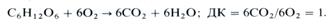
Количество кислорода, необходимое для окисления субстрата в процессе дыхания, находится в обратной зависимости от содержания его в молекуле субстрата: чем меньше атомов кислорода в молекуле субстрата, тем больше О2 тратится на окисление. Поэтому если субстратом дыхания являются более бедные кислородом (по сравнению с углеводами) жирные кислоты, то ДК будет меньше единицы. Примером может служить окисление стеариновой кислоты:
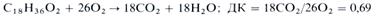
На окисление более окисленных, чем углеводы, органических кислот требуется меньше кислорода, что увеличивает дыхательный коэффициент, как видно из реакции окисления щавелевой кислоты:

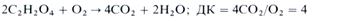
Однако величина дыхательного коэффициента определяется не только свойствами окисляемого субстрата. Она также зависит от снабжения тканей кислородом. При его недостатке (например, в меристеме кончиков корней, в семенах с плотными оболочками, при затоплении корней и т. д.) усиливается бро-
жение и ДК возрастает. Если в результате недоокисления продуктов в тканях накапливаются органические кислоты, а количество выделяемого СО2 снижается, ДК падает.
Таким образом, хотя степень окисленности дыхательного субстрата и может влиять на ДК, величина его скорее отражает особенности процесса дыхания данной ткани, органа, находящихся на определенной стадии онтогенеза при действии конкретных внешних условий.
 Эффект Пастера. Уровень О2 в тканях влияет не только на интенсивность дыхания, но определяет и величину расхо дования дыхательных субстратов, на что впервые обратил вни мание Л. Пастер. В его опытах с дрожжами в присутствии О2 снижались распад глюкозы и интенсивность брожения (уменьшалось количество спирта и выделяемого СО2), но одно временно наблюдался интенсивный рост биомассы дрожжей вследствие усиления использования Сахаров на синтетические процессы. Торможение распада Сахаров и более эффективное их использование в присутствии кислорода получило название «эффекта Пастера». t
Эффект Пастера. Уровень О2 в тканях влияет не только на интенсивность дыхания, но определяет и величину расхо дования дыхательных субстратов, на что впервые обратил вни мание Л. Пастер. В его опытах с дрожжами в присутствии О2 снижались распад глюкозы и интенсивность брожения (уменьшалось количество спирта и выделяемого СО2), но одно временно наблюдался интенсивный рост биомассы дрожжей вследствие усиления использования Сахаров на синтетические процессы. Торможение распада Сахаров и более эффективное их использование в присутствии кислорода получило название «эффекта Пастера». t
Механизм эффекта Пастера состоит в том, что в присутствии О2 интенсивно идущий процесс окислительного фосфо-рилирования конкурентно уменьшает количество молекул ADP, вступающих в гликолиз (на нужды субстратного фосфори-лирования). По этой причине, а также из-за тормозящего действия АТР (синтез которого резко возрастает в аэробных условиях) на фосфофруктокиназу, скорость процессов гликолиза в присутствии О2 снижается. Избыток АТР может способствовать и ресинтезу глюкозы из части молекул пирувата, образующегося в ходе гликолиза. Без кислорода не функционируют цикл Кребса и ПФП и, следовательно, клетки не получают многих промежуточных соединений, необходимых для синтеза клеточных структур. В присутствии О2 все эти циклы работают. Увеличение концентрации молекул АТР в условиях аэробиоза также способствует синтетическим процессам.
Дыхательный контроль. Возрастание функциональной активности клеток сопровождается усилением дыхания. В значительной степени это достигается благодаря механизму дыхательного контроля, или акцепторного контроля дыхания. Дыхательным контролем называют зависимость скорости потребления О2 митохондриями от концентрации ADP, который служит акцептором фосфата при окислительном фосфорили-ровании. В условиях полного сопряжения транспорта электронов по ЭТЦ с синтезом АТР интенсивность дыхательного процесса в митохондриях зависит от концентрации ADP или, точнее, от отношения действующих масс АТР-системы: [ATP]/[ADP][Pi]. Причем неорганический фосфат обычно присутствует в достаточном количестве и не является ограничивающим фактором. В клетке, находящейся в состоянии покоя, это отношение достаточно велико, так как почти весь ADP фосфорилирован.
При увеличении функциональной активности клеток АТР расходуется на энергозависимые процессы, в ре зультате чего возрастает концентрация ADP, а это в свою очередь приводит к повышению скорости переноса электронов и интенсивности окислительного фосфорилирования. Важно подчеркнуть, что в данном случае уровень ADP регулирует интенсивность транспорта электронов и окислительное фосфори-лирование не как аллостерический фактор, а как субстрат фосфорилирования.
Более полно состояние адениннуклеотидной системы выражается отношением, получившим название энергетического заряда:
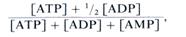
который характеризует меру заполнения всей адениннуклеотидной системы высокоэнергетическими фосфатными группами.
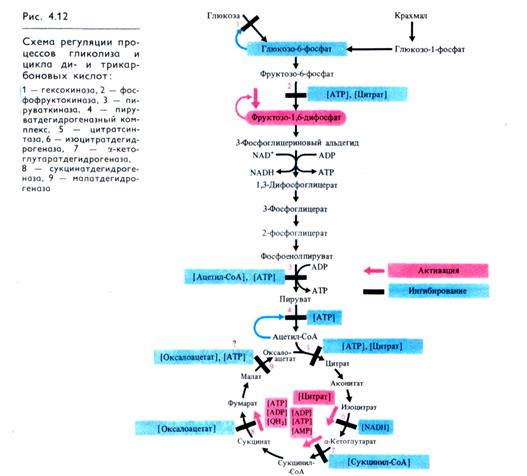
Регуляция гликолиза. Интенсивность гликолиза контролируется в нескольких участках (рис. 4.12). Вовлечение глюкозы в процесс гликолиза регулируется на уровне фермента гексокиназы по типу обратной связи: избыток продукта реакции (глюкозо-6-фосфата) аллостерически подавляет деятельность фермента.
Второй участок регуляции скорости гликолиза находится на уровне фосфофруктокиназы. Фермент аллостерически инги-бируется высокой концентрацией АТР и активируется неорганическим фосфатом и ADP. Ингибирование АТР предотвращает развитие реакции в обратном направлении при высокой концентрации фруктозо-6-фосфата. Кроме того, фермент подавляется продуктом цикла Кребса — цитратом и через положительную обратную связь активируется собственным продуктом — фруктоза-1,6-дифосфатом (самоусиление).
Высокие концентрации АТР подавляют активность пиру-ваткиназы, снижая сродство фермента к фосфоенолпирувату. Пируваткиназа подавляется также ацетил-СоА.
Наконец, пируватдегидрогеназный комплекс, участвующий в образовании ацетил-СоА из пирувата, ингибируется высокими концентрациями АТР, а также NADH и собственным продуктом — ацетил-СоА.
Регуляция цикла Кребса. Дальнейшее использование образующегося из пирувата ацетил-СоА зависит от энергетического состояния клетки. При малой энергетической потребности клетки дыхательным контролем тормозится работа дыхательной цепи, а следовательно, реакций ЦТК и образования интермедиатов цикла, в том числе оксалоацетата, вовлекающего ацетил-СоА в цикл Кребса. Это приводит к большему использованию ацетил-СоА в синтетических процессах, которые также потребляют энергию.
Особенностью регуляции ЦТК (рис. 4.12) является зависимость всех четырех дегидрогеназ цикла (изоцитратдегидроге-назы, 7-кетоглутаратдегидрогеназы, сукцинатдегидрогеназы, малатдегидрогеназы) от отношения [NADH]/[NAD+]. Активность цитратсинтазы тормозится высокой концентрацией АТР и собственным продуктом — цитратом. Изоцитратдегидроге-наза ингибируется NADH и активируется цитратом. а-Кетоглутаратдегидрогеназа подавляется продуктом реакции — сукцинил-СоА и активируется аденилатами. Окисление сукцината сукцинатдегидрогеназой тормозится оксалоацетатом и ускоряется АТР, ADP и восстановленным убихиноном (QH2). Наконец, малатдегидрогеназа ингибируется оксалоацетатом и у ряда объектов — высоким уровнем АТР. Однако степень участия величины энергетического заряда, или уровня адениновых нуклеотидов, в регуляции активности цикла Кребса у растений до конца не выяснена.
Регулирующую роль может играть также альтернативный путь транспорта электронов в растительных митохондриях. В условиях высокого содержания АТР, когда активность основной дыхательной цепи снижена, окисление субстратов через альтернативную оксидазу (без образования АТР) продолжается, что поддерживает на низком уровне отношение NADH/NAD+ и снижает уровень АТР. Все это позволяет циклу Кребса функционировать.
Регуляция ПФП и глиоксилатного цикла. Пентозофосфатный путь окисления регулируется концентрацией NADP+, так как содержит две NADP-зависимые дегидрогеназы (глюкозо-6-фосфатдегидрогеназу и 6-фосфоглюконатдегидрогеназу). Он регулируется также уровнем синтезов в клетке, потребляющих NADPH (например, синтезом аминокислот и белков). Их высокий уровень приводит к увеличению содержания окисленного NADP +, что стимулирует ПФП.
В регуляции соотношения между ПФП и гликолизом принимает участие ряд интермедиатов: неорганический фосфат, 6-фосфоглюконовая кислота, эритрозо-4-фосфат. Недостаток неорганического фосфата подавляет гликолиз и активирует ПФП. 6-Фосфоглюконовая кислота служит ингибитором гли-колитического фермента фосфофруктокиназы (глюкозофосфа-тизомеразы), что способствует функционированию ПФП. Эритрозо-4-фосфат, являясь субстратом транскетолазной и транс-альдолазной реакций, может тормозить активность ферментов гликолиза и тем самым переключать превращения углеводов с гликолитического на пентозофосфатный путь.
 Активность глиоксилатного цикла снижается при повышении концентрации оксалоацетата, который ингибирует сукци-натдегидрогеназу ЦТК. Другой ингибитор цикла — фосфоенол-пируват подавляет активность изоцитратлиазы.
Активность глиоксилатного цикла снижается при повышении концентрации оксалоацетата, который ингибирует сукци-натдегидрогеназу ЦТК. Другой ингибитор цикла — фосфоенол-пируват подавляет активность изоцитратлиазы.
 2015-05-26
2015-05-26 2224
2224
