Электродные потенциалы зависят от природы веществ, участвующих в электродном процессе, от соотношения между активностями этих веществ и температуры. Для разбавленных растворов, эта зависимость выражается уравнением Нернста в следующей форме:
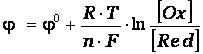
где Φ0 - стандартный электродный потенциал данного процесса, R = 8,31 Дж/(мольК) - универсальная газовая постоянная, T - абсолютная температура раствора, n - число молей электронов передаваемых в процессе, F = 96500 Кл/моль - постоянная Фарадея, [Ox] и [Red] – произведения концентраций веществ, участвующих в процессе в окисленной (Ox) и восстановленной (Red) формах. В общем случае в уравнении Нернста вместо концентраций необходимо использовать активности веществ.
После подстановки значений постоянных величин для стандартной при электрохимических измерениях температуре Т = 298 К уравнение Нернста имеет вид:
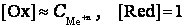
Тогда
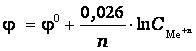
 2015-05-26
2015-05-26 358
358







