О направлении ОВР можно судить по изменению энергии Гиббса ∆ G. Если ∆ G < 0 – реакция возможна, если ∆ G > 0 - невозможна. Из термодинамики известно, что ∆ G = - n · F · E; E = φок-ля -φв-ля или φок-ля > φв-ля, что возможно при Е > 0 и ∆ G < 0.
Рассмотрим реакцию:
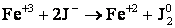
Она состоит из двух полуреакций:
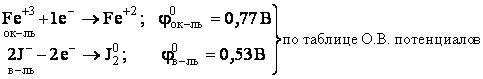
Т.к. φок-ля > φв-ля, то возможно самопроизвольное протекание реакции слева направо.
2FeCl3 + 2KJ → 2FeCl2 + J2 + 2KCl
Из всех возможных при данных условиях О.В.Р. в первую очередь протекает та, которая имеет наибольшую разность окислительно – восстановительных потенциалов.
О.В.Р. протекают в сторону образования более слабых окислителей и восстановителей из более сильных.
Роль окислительно-восстановительных процессов. О.В.Р. играют важную роль в природе и технике. О.В.Р. – это процессы фотосинтеза у растений, процессы дыхания у животных и человека, процессы горения топлива. Иногда О.В.Р. наносят ущерб природе и человеку, например, при коррозии металлов, лесных пожарах, образовании токсичных диоксинов.
При помощи О.В.Р. получают металлы, органические и неорганические соединения, проводят анализ различных веществ, очищают природные и сточные воды, газовые выбросы.
 2015-05-26
2015-05-26 487
487








