Во многих химических реакциях происходит перемещение электронов от одних частиц к другим. Такие реакции называют окислительно-восстановительными (ОВР).
Для характеристики состояния элементов в соединениях введено понятие степени окисления.
Число электронов, смещенных от атома данного элемента или к атому данного элемента, называют степенью окисления (С.О.).
Поэтому все реакции, наблюдаемые в природе, делят на 2 группы:
а) протекающие без изменения С.О.: (реакции обмена, нейтрализации)
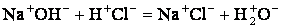
б) протекающие с изменением С.О.. Такие реакции называют окислительно-восстановительными.
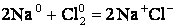
Частицы, отдающие электроны, называются восстановители, они окисляются. Частицы, принимающие электроны, называются окислителями, они восстанавливаются. В химических окислительно-восстановительных реакциях окисление и восстановление взаимосвязаны.
Степень окисления можно рассматривать как условный заряд атома в соединении, вычисленный исходя из предположения, что соединение состоит из ионов. Степень окисления может быть положительная, отрицательная и нулевая.
Определение степени окисления проводят, используя следующие правила:
1. Степень окисления кислорода в соединениях равна (-2). Исключение составляют: пероксиды – 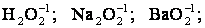 фторид кислорода
фторид кислорода 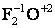
2. Степень окисления водорода в соединениях равна (+1), кроме гидридов металлов - LiH, CaH2 и т.п., где степень окисления равна (-1).
3. Степень окисления атомов в простых веществах, например, в металле или в Н2, О2 равна 0.
4. Степень окисления щелочных металлов в соединениях равна (+1).
5. Алгебраическая сумма степеней окисления всех атомов, входящих в состав нейтральной молекулы равна 0, в сложном ионе – заряду иона.
 2015-05-26
2015-05-26 479
479








