· молярная концентрация (молярность раствора)- См - показывает количество (моль) растворенного вещества, содержащегося в 1 л раствора. (1л= 1дм3). Молярную концентрацию определяют по формуле: См= 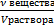 и измеряют в моль/л или в моль/м3(в системе СИ).
и измеряют в моль/л или в моль/м3(в системе СИ).
Например, запись 0,1М раствор H2SO4означает, что в 1л такого раствора содержится 0,1 моль (9,8г) H2SO4. Растворы с концентрацией 0,1М принято называть децимолярными, а с концентрацией 0,01М – сантимолярными.
· молярная концентрация эквивалента (нормальная концентрация или нормальность раствора) Сн. или N показывает количество эквивалентов растворенного вещества, содержащегося в 1л раствора. Нормальность раствора определяют по формуле: Cн.= νэв-ва/Vр-ра и измеряют в моль-экв./л.
Например, запись 0,1N или 0,1н. раствор H2SO4означает, что в 1л такого раствора содержится 0,1 моль-эквивалентов (4,9г) H2SO4.
Таким образом, молярная и нормальная концентрации растворов связаны между собой следующим соотношением: Сн.= z ∙ См,где z – число эквивалентности.
Растворы с концентрацией 0,1н. принято называть децинормальными, а с концентрацией 0,01н. – сантинормальными.
· моляльность раствора Сm показывает количество растворенного вещества, содержащегося в каждых 1000г (1 кг) растворителя: Cm= νв-ва/1000г р-ля и выражается в моль/кгр-ля.
· титр раствора (Т) - масса (г) растворенного вещества в 1 мл раствора, выраженная в г/мл.
При решении расчетных задач с использованием понятий о концентрации растворов, следует помнить, что общую массу раствора можно вычислить по формулам: mр-ра= mраст.в-ва + mрастворителя, или mр-ра= ρр-ра∙ Vр-ра, где ρр-ра – это плотность раствора, т.е. масса 1мл раствора; измеряется в г/мл или в г/см3. При этом помнить, что 1мл=1см3, а ρводы=1г/см3 или 1г/мл при комнатной температуре.
Плотность растворов определяют либо по справочным таблицам, либо экспериментально с помощью специально калиброванных приборов (ареометров), типа поплавка, при погружении которых в раствор можно немедленно получить информацию о концентрации раствора. Для более точных измерений используют пикнометры.
Часто случается, что плотность раствора по ареометру не отвечает значениям, приведенным в таблице, а находится где-то вблизи. В этом случае для нахождения процентной концентрации используют метод интерполяции.
Например, при определении плотности раствора ареометр показал значение ρ = 1,138г/см3, а в таблице имеются значения: ρ %
1,132 18
1,140 19
∆ρ - 0,008 ∆% - 1%
Разность между значением плотности, найденной ареометром, и ближайшим табличным значением равна: 1,140-1,138=0,002. Далее составляем пропорцию:
0,008 - 1%
0,002 - х, откуда х = 0,002/0,008 = 0,25%
Найденную величину вычитаем из значения концентрации, которое соответствует использованному значению плотности: 19 – 0,25 = 18,75%.
Аналогичным образом можно решать и обратные задачи, т.е. методом интерполяции рассчитывать теоретические плотности растворов таких концентраций, которые не приводятся в справочных таблицах, например, 7,5% и других.
· Определение концентрации растворов методом титрования
Среди многочисленных методов определения концентрации раствора особое место занимает титрование.
Титрование лежит в основе титриметрического, или объемного анализа – метода количественного химического анализа, основанного на измерении объема одного реагента, затраченного на реакцию с определяемым реагентом. По типу протекающих при титровании реакций различают кислотно-основное титрование, окислительно-восстановительное и другие титриметрические методы.
Из закона эквивалентов известно, что вещества реагируют и образуются в строго эквивалентных соотношениях, т.е. νэ1= νэ2=…и т.д. Пользуясь нормальными концентрациями растворов, можно рассчитать, в каких объемных соотношениях их следует смешивать, чтобы растворенные в них вещества прореагировали без остатка. Например, если V1л раствора вещества 1 с нормальностью N1 реагирует с V2л раствора вещества 2 с нормальность N2, это означает, что в реакцию вступило V1 ∙ N1 эквивалентов вещества 1 и V2 ∙ N2 эквивалентов вещества 2. Тогда математически закон эквивалентов для растворов можно записать в виде следующих соотношений:
V1N1= V2N2 или V1:V2= N2:N1
Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
На основании этого соотношения можно не только вычислять необходимые для проведения реакции объемы растворов, но и по объемам пошедших на реакцию растворов определять их концентрации, а значит, и массы прореагировавших веществ.
Титрование представляет собой постепенное приливание раствора известной концентрации (стандартного раствора, или титранта) к анализируемому раствору неизвестной концентрации, но точно заданного объема (аликвотная доля, или аликвота).
Момент титрования, в который количества эквивалентов реагирующих веществ оказываются равными (вещества прореагируют друг с другом полностью), называют точкой эквивалентности (ТЭ) (стехиометрическая точка, теоретическая конечная точка).
Приливание стандартного раствора производится при помощи калиброванной бюретки и заканчивается в момент, когда резко изменяется окраска анализируемого раствора в присутствии индикатора. Этот момент называют конечной точкой титрования КТТ. КТТ более или менее соответствует ТЭ, но чаще всего не совпадает с ней, чем может обусловливать ошибки метода.
Внимание! Тема “Способы выражения состава растворов” войдет в первую часть коллоквиума №1. Следует уметь:
· давать определения понятиям: раствор, растворенное вещество, растворитель, растворимость, коэффицент растворимости, массовая доля, молярная и объемная доли, молярная и нормальные концентрации, моляльность и титр раствора;
· приводить формулировки и математические записи закона эквивалентов для растворов;
· решать расчетные задачи с использованием всех вышеперечисленных величин, понятий и законов.
Лабораторная работа №4 “Приготовление раствора заданной концентрации ”
· Цель работы: приготовить раствор приблизительно заданной концентрации и определить ее по значению плотности полученного раствора.
· Оборудование и реактивы: электронные весы, химический стакан на 100-150мл, мерный цилиндр на 100 мл, стеклянная палочка, набор ареометров, сухая поваренная соль (NaClтв).
· Получить задание у преподавателя: приготовить водный раствор поваренной соли объемом V = … мл с процентной концентрацией ωтеор. = … %.
· По справочным таблицам или методом интерполяции определить плотность раствора, который следует приготовить – ρтеор.
· Вычислить массу соли (в г) и объем воды (в мл), необходимые для приготовления заданного раствора, используя при расчетах значение ρтеор.
· Взять навеску соли, т.е. взвесить на электронных весах (на часовом стекле или на кусочке фильтровальной бумаги) рассчитанную массу соли и аккуратно перенести ее в химический стакан на 100-150 мл.
· С помощью мерного цилиндра отмерить (по нижнему мениску) рассчитанный объем воды и перелить ее в стакан с солью. Перемешать раствор до полного растворения соли.
· С помощью ареометра определить плотность приготовленного раствора – ρэксп.
Сделать рисунок ареометра.
| Ареометр (рисунок 48)представляет собой стеклянный поплавок со шкалой плотности (г/см3). Изучаемую жидкость наливают в стеклянный цилиндр на ¾ его объема и осторожно погружают ареометр в жидкость, следя за тем, чтобы он в этой жидкости плавал и не касался при этом стенок цилиндра. Если шкала ареометра находится выше или ниже уровня жидкости в цилиндре, то следует взять ареометр с другими пределами измерения плотности. То значение на шкале ареометра, до которого он погружается в жидкость, и будет отвечать его плотности, т.е. ρэксп.Плотность воды, как известно, равна 1,000г/см3. Растворы солей, кислот и оснований имеют плотности, большие плотности воды, поэтому при экспериментальном определении плотности следует двигаться по шкале сверху - вниз. Численное значение плотности указывается до третьего знака после запятой. · По измеренной плотности следует определить точное значение процентного содержания соли в приготовленном растворе (ωэксп.) по табличным данным или методом интерполяции. |  Рис. 48 Ареометр Рис. 48 Ареометр |
· Найденное значение ωэксп. сравнить с заданным значением ωтеор. и найти относительную ошибку эксперимента: ε = (ωтеор. - ωэксп.)/ ωтеор.
· Рассчитайте молярную (См) и нормальную (Сн.) концентрации приготовленного вами раствора, а также его моляльность (Сm) и титр (Т).
· Сделайте выводы по проделанной работе, проанализировав операции и стадии, на которых могли быть допущены ошибки.
 2015-05-26
2015-05-26 1992
1992








