Итак, основной количественной характеристикой растворов является концентрация. Под концентрацией раствора понимают массу или объем растворенного вещества, содержащегося в определенной массе или объеме раствора или растворителя. В химической практике наиболее часто употребляют следующие способы выражения концентрации растворенного вещества в растворе:
Внесистемные единицы
· Массовая доля (ω) – отношение массы растворенного вещества к общей массе раствора: ω = 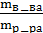 ; массовая доля в этом случае выражается в долях единицы. Однако, в
; массовая доля в этом случае выражается в долях единицы. Однако, в
подавляющем большинстве случаев, при решении задач массовая доля выражается в процентах (ω%) и называется в таком случае процентной концентрацией.
С%= ω% (раств. в-ва) = 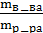 ∙ 100%
∙ 100%
· Процентная концентрация раствора показывает массу (г или кг) растворенного вещества в каждых 100 г (или кг) раствора.
Например, 15%-ый раствор NaOH означает, что
в каждых 100г раствора содержится 15г NaOH и 85г H2O;
в каждых 100 кг раствора содержится 15 кг NaOH и 85 кг Н2О;
для приготовления 100 г (кг) 15% -го раствора необходимо в 85 г (кг) воды растворить 15г (кг) NaOH.
· молярная доля (nв-ва) – отношение числа молей данного компонента к сумме молей всех компонентов раствора: xi= νi/∑ νi, где νi– число молей i-го компонента,
∑ νi – общее число молей;
· растворимость вещества (S) – численно равна содержанию (концентрации) растворенного вещества в насыщенном растворе при данной температуре. Максимальную массу безводного вещества в граммах, которую можно растворить в 100 г растворителя при данной температуре, называют коэффициентом растворимости, или просто растворимостью. Растворимость может быть выражена в граммах растворенного вещества на 100г растворителя, реже - в граммах вещества на 1л растворителя или в моль/л.
 2015-05-26
2015-05-26 2419
2419








