А)
1. 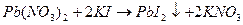 (реакция «Золотого дождя»)
(реакция «Золотого дождя»)
Выпадает осадок жёлтого цвета
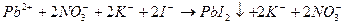
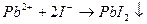
2.Рb(NO3)2 +BaCl2 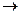 PbCl2 + Ba(NO3)2
PbCl2 + Ba(NO3)2 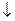
Выпадает осадок белого белого цвета
Pb2+ + 2NO3- + Ba2+ + 2Cl- 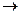 Pb2+ + 2Cl - +Ba(NO3)2
Pb2+ + 2Cl - +Ba(NO3)2 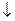
Ba2+ + 2NO3- 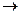 Ba(NO3)2
Ba(NO3)2 
Вывод: реакции идут, т.к. образуются малорастворимые в воде вещества.
Опыт 4.Изучение свойств амфотерных гидроксидов.
А)
1. 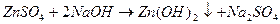
Наблюдаем выпадение осадка белого цвета
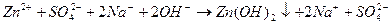
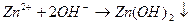
2. 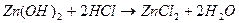
Наблюдаем растворение осадка и получение исходного вещества
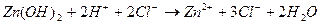
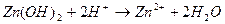
3. Zn(OH)2 + 2NaOH(в изб.)  Na2
Na2 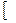 Zn(OH)4
Zn(OH)4 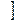
При избытке NaOH осадок растворяется 
Вывод: Гидроксид в кислой среде реагирует как основание, а в щелочной как кислота.
 2015-05-26
2015-05-26 1882
1882








