Молярная массавещества: МНОС3Н6ОН = 76 г/моль
Масса 1 л раствора (ρ = 1 г/см3 = 1 кг/дм3): mр-ра = V.ρ.1000 = 1.1.1000= 1000 г
Масса растворителя в 1 л раствора: mН2О = mр-ра –mв-ва = 1000 – 8 =992 г
Моляльная концентрация вещества:
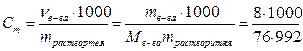 = 0,106 моль/кг Н2О
= 0,106 моль/кг Н2О
По закону Рауля повышение температуры кипения раствора (ΔТкип) и понижение температуры замерзания (ΔТз) по сравнению с температурой кипения и температурой кристаллизации чистого растворителя не зависит от природы растворённого вещества и прямо пропорциональна моляльной концентрации растворённого вещества. Последняя определяется числом молей растворённого вещества в 1000 г растворителя. Закон Рауля выражается
ΔТ == К*Сm
,где Cm - моляльная концентрация
К – криоскопическая или эбулиоскопическая константа;
Т кип(Н2О)= t кип(Н2О)+273=100+273=373K
Т з(Н2О)= t з(Н2О)+273=0+273=273K
Тогда: Т кип= Т кип(Н2О)+ ΔТкип= Т кип(Н2О)+ Кэ* Сm=373+0,516*0,106=373,06 К
Т з= Т з(Н2О)- ΔТз= Т з(Н2О)- Кк* Сm=273-1,86*0,106=272,80 К
Задача 16.
Определите осмотическое давление раствора сахарозы при 0° С, если при 20°С осмотическое давление этого же раствора равно 1,066×105Па.
 2015-05-26
2015-05-26 1152
1152








