Самый простой и поэтому наиболее распространенный способ определения рН состоит в применении кислотно-основных индикаторов. Точность этого способа определения рН обычно невелика и составляет около одной единицы рН.
Индикаторы – это чаще всего органические соединения, которые меняют окраску под влиянием кислоты или основания. Общей чертой индикаторов является то, что они подвергаются в растворе кислотной или основной диссоциации и являются слабыми электролитами.
Кислотный индикатор: HInd ↔ H+ + Ind–
Основной: IndOH ↔ Ind+ + OH-
Для определения константы диссоциации используем закон действующих масс
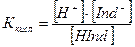
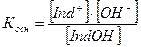
Концентрации ионов Н+ и ОН– будут равны:
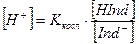
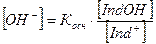
Рассмотрим изменение окраски индикатора в зависимости от реакции среды, на примере индикатора – слабой кислоты.
При какой-то определенной реакции среды количество диссоциированных молекул равно количеству недиссоциированных. В этом случае [HInd] = [Ind–],
т.е. их отношение равно 1. Следовательно в этом случае [H+] = Ккисл. Взяв отрицательный логарифм, получим рН = рК.
рК – называется точкой перехода индикатора – это то значение рН при котором количество недиссоциированных и диссоциированных молекул одинаково.
Сдвиг реакции среды в ту или иную сторону от точки перехода сопровождается нарушением соотношения окрашенных форм индикатора и следовательно, изменением цвета, указывающего на преобладание в растворе кислотных или щелочных форм. Так, например для индикатора метиловый красный при рН < рК преобладает окраска недиссоциированных молекул (красная), при рН > рК преобладает окраска анионов – желтая, при рН=рК окраска будет смешанная (оранжевая).
Точки перехода разных индикаторов соответствуют различным значениям рН. Область значений рН, в которой происходит различимое глазом изменение цвета индикатора, называется зоной перемены окраски индикатора. Величина этой зоны выражается приблизительно в 2 единицах рН, т.е.
рН = рК ± 1
Различные индикаторы имеют разную ширину своей зоны. Чем уже зона, тем чувствительнее индикатор. Точка перехода каждого индикатора лежит приблизительно в середине зоны перемены окраски.
Чтобы индикатор мог выполнять свою функцию его кислотная форма должна отличаться по окраске от основной. Метилоранж, метиловый красный относятся к так называемым двухцветным индикаторам (оранжевый – щелочной раствор, красный - кислый).
Фенолфталеин – одноцветный индикатор (красный – кислый раствор, бесцветный – щелочной).
Для определения рН раствора с большей точностью, чем 1 – 2 единицы рН применяют колориметрический и потенциометрический методы измерения. На практике значительно чаще используют потенциометрический метод при котором значение рН определяют с помощью прибора, который называется потенциометр или рН-метр. Он позволяет точно измерить Э.Д.С. элемента, состоящего из двух электродов, погруженных в исследуемый раствор. Один из этих электродов выполняет функцию электрода сравнения, т.е. электрода с постоянным и известным потенциалом. Относительно этого электрода измеряют потенциал второго индикаторного электрода. Его потенциал линейно связан с логарифмом концентрации ионов водорода. В качестве основного индикаторного электрода используют водородный, хингидродный, сурьмяный или стеклянный электроды. Электродом сравнения служит каломельный электрод.
 2015-05-26
2015-05-26 2395
2395








