СЛ. 10 (0) величина 1/r, обратная удельному сопротивлению, называемая удельной электропроводностью. Обозначается она буквой c (греч. «каппа»), С учетом этого обозначения уравнение (***) примет вид: 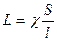
(1) Если S = 1 см2, а l — 1 см, то L, = c. Удельная электропроводность электролита c представляет собой величину, обратную сопротивлению столба раствора длиной в 1 см и площадью сечения в 1 см2. Измеряется удельная электропроводность в [Ом -1*см -1].
Поскольку в растворах электролитов при прохождении электричества ионы перемещаются между электродами и отдают свой заряд только на их поверхности, то в приведенной формуле S обозначает площадь, l — расстояние между электродами.
(2) Например, удельное сопротивление образца воды при 18°С равно r =2*106ом• см. Удельная электропроводность этого образца воды будет равна:
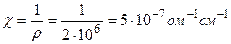
Если мы опустим в эту воду два электрода площадью в 1 см2, то при расстоянии между электродами в 1 см и разности потенциалов в 1 в сила тока будет равна 5 • 10-7 а (при 18° С). Электропроводность растворов электролитов зависит от общего числа их ионов в единице объема раствора. Вследствие этого удельная электропроводность электролитов зависит от концентрации раствора. По мере увеличения концентрации электролита удельная электропроводность сначала растет, а затем уменьшается, так как вместе с ростом числа ионов уменьшается скорость их перемещения, а также степень диссоциации вещества. Первый фактор действует в растворах сильных электролитов, второй – в растворах слабых электролитов. При достижении определенной концентрации раствора влияние перечисленных факторов становится настолько значительным, что дальнейшее увеличение концентрации приводит к уменьшению электропроводности (рис. 2 СЛ. 11).
Удельная электропроводность растворов электролитов зависит также от индивидуальных свойств ионов. Дело в том, что количество переносимого ионами электрического тока в растворе электролита зависит не только от числа ионов в единице объема, но и от скорости их движения.
Известно, что различные ионы движутся в электрическом поле с неодинаковой скоростью. В табл. 1 СЛ. 12 приведены значения скорости движения некоторых ионов, отнесенные к падению потенциала в 1 в/см (абсолютные скорости движения ионов).
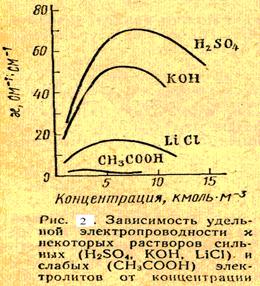
Таблица 1
Абсолютные скорости ионов (см*сек) в воде при 18°С и разности потенциалов 1 в/см
| Катионы | Скорость 10-4 | Анионы | Скорость 10-1 |
| H+ | 32,7 | OH- | 18,70 |
| Li+ | 3,50 | Cl- | 6,85 |
| Na+ | 4,60 | NO3- | 6,40 |
| K+ | 6,75 | I- | 6,95 |
| NH4+ | 6,70 | MnO4- | 5,60 |
Как видно из табл. 1 скорости движения ионов при прохождении электрического тока в общем очень малы по сравнению со скоростями движения молекул в газах. Так, ион водорода в водной среде движется приблизительно в сто миллионов раз медленнее, чем молекула Н2 в газообразной среде. Объясняется это тем, что ионы в воде гидратированы и при движении испытывают огромное сопротивление со стороны среды (растворителя). Из данных табл. 1 видно, что ионы Н+ и ОН- обладают по сравнению со всеми другими ионами наибольшими абсолютными скоростями, что нельзя объяснить только малым радиусом ионов Н+ и ОН-. Радиус ОН- -иона (1,40А°) соизмерим с радиусами других ионов, ион Н+ в водных растворах существует лишь в виде иона гидроксония Н3О+, радиус которого также сравним с радиусами многих ионов.
Электропроводность растворов зависит также и от заряда ионов: чем он выше, тем большее количество электричества переносит ион с одного электрода на другой. Так, каждый двухзарядный анион отдает аноду два электрона, а однозарядный – только один.
Удельная электропроводность растворов зависит также от температуры. Эта зависимость довольно сложная. При повышении температуры скорость движения ионов возрастает в связи с уменьшением вязкости среды. Кроме того, изменение температуры влияет на степень электролитической диссоциации электролита и тем самым на электропроводность раствора. Повышение температуры на 1°С ведет к ускорению движения ионов, а следовательно, к возрастанию электропроводности раствора на 1,5—2,7%.
Поскольку удельная электропроводность зависит от многих факторов, на основе ее изучения не представляется возможным- сделать каких-либо выводов общего характера. Поэтому для удобства учета влияния на электропроводность растворов электролитов их концентрации и взаимодействия между ионами Ленцем было введено понятие об эквивалентной электропроводности.
 2015-05-26
2015-05-26 9757
9757
