Основные положения теории:
1 Соли, кислоты и основания при растворении в воде и некоторых других полярных растворителях диссоциируют на ионы.
2 Ионы существуют в растворе независимо от того, проходит через раствор электрический ток или нет. Вследствие этого число независимо движущихся частиц растворенного вещества больше, чем при отсутствии диссоциации, и коллигативные свойства электролитов возрастают в i раз.
3 Процесс диссоциации описывается законом действующих масс (протекает обратимо). При уменьшении концентрации диссоциация становится практически полной
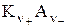 ↔ ν+ Kz+ + ν – Az-
↔ ν+ Kz+ + ν – Az-
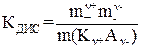
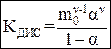
В частном случае при ν+=ν–=1
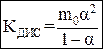 – математическая запись закона разведения Оствальда
– математическая запись закона разведения Оствальда
Здесь ν = ν++ ν– – общее число ионов, образующихся при диссоциации одной молекулы,
m+, m– – моляльные концентрации ионов,
m(Kν+Aν–) – моляльная концентрация недиссоциированных молекул,
m0 – моляльная концентрация раствора при расчете на полностью недиссоциированное вещество,
α – степень диссоциации – доля диссоциированных молекул,
КДИC – практическая константа диссоциации.
4 Коэффициент Вант-Гоффа i – изотонический коэффициент – связан со степенью электролитической диссоциации. i – среднее суммарное число частиц (ионов и молекул), образующихся при диссоциации одной молекулы
i = ν + α + ν- α + (1–α) = 1 + (ν++ ν–−1)α = 1 + (ν – 1)α i = 1+(ν–1)α.
По мере увеличения разведения (уменьшения концетрации) коэффициент Вант-Гоффа приближается к простому целому числу (2,3,4 – в зависимости от числа ионов, образующихся при диссоциации молекул вещества):
NaCl = Na+ + Cl- i → 2
K2SO4 = 2K+ + SO 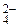 i → 3
i → 3
AlCl3 = Al3+ + 3Cl- i → 4
K4[Fe(CN)6] = 4K+ + [Fe(CN)6]2- i → 5
 2015-05-26
2015-05-26 524
524








