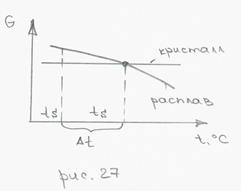
G – запасенная внутренняя энергия (энергия Гиббса);
∆t – степень переохлаждения расплава
При температуре ts кристаллизация вещества не может начаться, т.к. это не создаст никакого выигрыша во внутренней энергии. Кристаллизация может начаться при ts’, когда процесс дает выигрыш в энергии GV.
Баланс энергии:
1) 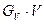 - выигрыш (V – объем зародыша);
- выигрыш (V – объем зародыша);
2) 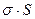 - затрата (σ – удельная поверхностная энергия, S – площадь поверхности зародыша.
- затрата (σ – удельная поверхностная энергия, S – площадь поверхности зародыша.
Если 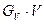 >
> 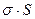 - момент начала кристаллизации.
- момент начала кристаллизации.
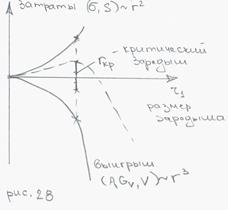
критический зародыш – произвольный кристалл
 , чем больше ∆GV, чем больше ∆t, тем меньший зародыш устойчив и большее их количество будет образовываться.
, чем больше ∆GV, чем больше ∆t, тем меньший зародыш устойчив и большее их количество будет образовываться.
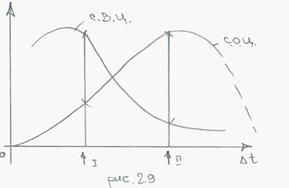
С.О.Ц – скорость образования центров;
С.Р.Ц – скорость роста центров;
I - ∆t мало, значит, крупное зерно;
II - ∆t велико, значит, мелкое зерно.
 2015-05-26
2015-05-26 320
320








