Пример: процесс кристаллизации расплав-кристалл (ж-тв)
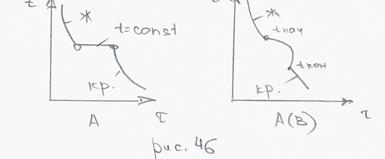
С = 1+1-2 = 0, такое превращение безвариантное и идет при постоянной температуре.
С = 2+1-2 = 1, кристаллизация твердого раствора обязана идти в интервале tн – tк, есть 1 степень свободы.
Общий закон выглядит так:
«Любое превращение подчиняется физическому правилу фазового равновесия, которое устанавливает четкое соответствие между числом компонентов К, числом фаз Ф и числом степеней свободы С, которые можно менять не влияя на фазовый состав»
К – А, В, С, …
Ф – ж, А, В, А(В), АmBn, …
С – t, P, концентрационный компонент.
При Р = const, С = К+1-Ф.
Выводы:
1. Условия протекания и превращения не случайны, температура начала и конца любого превращения названа критической точкой, например:
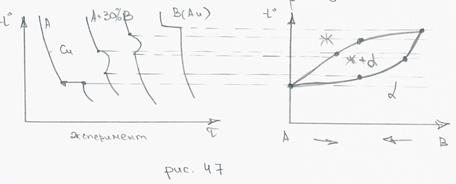
На любой диаграмме состояния между одинарными фазами есть двойные.
2. Совокупность критических точек начала и конца превращения образуют границу фазовых областей.
3. Диаграмма состояния показывает расположение всех границ фазовых областей в зависимости от составов сплавов и температуры.
 2015-05-26
2015-05-26 384
384








