Растворимость соли С (моль/дм3) — это ее равновесная молярная
концентрация в насыщенном растворе. В случае малорастворимой соли ее
растворимость в единицах молярной концентрации можно рассчитать, измерив
электрическую проводимость насыщенного раствора такой соли по
уравнению:
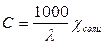 . (30)
. (30)
Молярная электрическая проводимость такого раствора (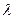 ) практически равна молярной проводимости его при бесконечном разведении (
) практически равна молярной проводимости его при бесконечном разведении (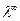 ),
),
вследствие малой концентрации электролита в растворе. Величину 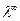 можно рассчитать по справочным данным, используя уравнение (17). Вместо удельной электрической проводимости соли (
можно рассчитать по справочным данным, используя уравнение (17). Вместо удельной электрической проводимости соли (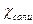 ) используют разность (
) используют разность (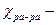
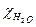 ), так как проводимости воды и раствора в этом случае
), так как проводимости воды и раствора в этом случае
соизмеримы. Таким образом, определив величину 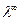 и удельные
и удельные
электрические проводимости воды и раствора исследуемой соли, можно
вычислить растворимость соли по уравнению:
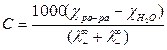 , моль дм-3.
, моль дм-3.
Зная растворимость соли, определяют ее произведение растворимости (KS), то есть константу равновесия гетерогенной реакции растворения малорастворимой соли:
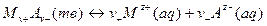 . (31)
. (31)
Константа равновесия такой реакции, называемая произведением растворимости соли, равна:
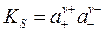 , (32)
, (32)
где a+ и a -— активности катиона и аниона в растворе. Если в растворе отсутствуют электролиты, содержащие ионы исследуемой соли и практически полностью отсутствуют другие электролиты, то, учитывая малую растворимость соли, можно перейти от активностей компонентов к их концентрациям. Тогда из уравнения (32) получаем:
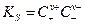 .
.
Исходя из (31) концентрация катионов 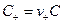 и анионов
и анионов 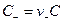 ,
,
получаем:
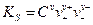 , (33)
, (33)
где 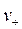 +
+ 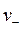 =
= 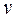 , С — молярная концентрация соли в исследуемом растворе (растворимость соли).
, С — молярная концентрация соли в исследуемом растворе (растворимость соли).
Таким образом, произведение растворимости малорастворимой соли
определяется концентрацией насыщенного раствора этой соли и числом ее
ионов в растворе.
Например,
1. 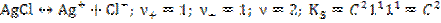 .
.
2. 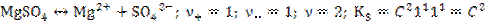 .
.
3. 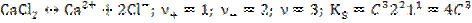
4. 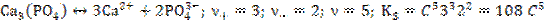
 2015-05-26
2015-05-26 469
469








