ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ МАРГАНЦА С УДАЛЕНИЕМ
ХЛОР-ИОНА ВЫПАРИВАНИЕМ С СЕРНОЙ КИСЛОТОЙ
Ионы марганца, встречаются в природных водах в виде гидрокарбонатов, сульфатов, хлоридов и фосфатов.
Присутствие в воде солей марганца в воде придает ей неприятный болотистый привкус, делает ее непригоднойдля питья, промышленных и хозяйственных целей.
Наличие в воде солей двухвалентного марганца способствует развитию в такой воде марганцевых бактерий. Их колонии закупоривают водопроводные трубы, затрудняя транспортировку воды.
Метод определения концентрации двухввалентного марганца основан на его окислении до иона MnO4-. Окисление происходит в кислой среде под действием персульфата аммония или калия в присутствии серебра в качестве катализатора. При этом в реакционной среде появляется розовое окрашивание.
I. Приготовление стандартной шкалы
В колбы вместимостью 50 мл вносят по 0; 1,0; 2,0; 3,0; 5,0; 8,0 мл / 1 мл раствора, который содержит 0,01мг Мn2+ стандартного раствора сернокислого марганца. Затем в каждую колбу добавляют до объема 10 мл 20%-ного раствора ортофосфорной кислоты,а также по 10мл 1%-ного раствора азотнокислого серебра и около 0,3 г персульфата аммония или калия, затем доливают дистиллированную воду до объема около 40 мл, нагревают до кипения и держат на водяной бане 10 мин. После охлаждения доводят объем раствора водой до метки и перемешивают. Оптическую плотность стандартных растворов измеряют на ФЭКе с зеленым светофильтром /λ=530 нм/, используя кюветы с толщиной рабочего слоя 20-50 мм. Пополученным данным строят калибровочный график по которому определяют содержание марганца [1].
2. Проведение анализа.
К 50 мл исследуемой пробы воды, налитой в фарфоровую чашку, прибавляют 5мл серной кислоты [1-2] и выпаривают на песчаной бане до полного удаления кислоты.
Сухой остаток смачивают небольшим количеством дистиллированной воды. Затем прбавляют к смеси 5 мл концентрированной азотной кислоты и 10 мл горячей дистиллированной воды. К смеси добавляют 3 мл 0,1 н АgNO3, 0,2г персульфата аммония и нагревают раствор до тех пор, пока интенсивность окраски не перестанет увеличиваться.
После охлаждения раствора, доводят его объем дистиллированной водой в мерной колбе вместимостью 50 мл до метки и измеряют на ФЭКе значение оптической плотности.
При анализе воды с большим содержанием марганца применяют также способ колориметрического титрования. Для этого 50 мл исследуемой воды, содержащей МпО4- переносят в стакан вместимостью 100 мл, а в другой стакан той же вместимости прибавляют дистиллированную воду в объеме, равном объему исследуемого раствора. Поставив оба стакана рядом на белую бумагу, приливают в стакан с дистиллированной водой из бюретки стандартный раствор перманганата калия, пока окраска в обоих стаканах не будет одинаковой. По объему израсходованного раствора КМпО4 вычисляют содержание марганца в исследуемой воде.
3.Обработка результатов
Содержание марганца /Х/ мг/л, определяют по формуле:
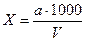 ,
,
где а - содержание Мn, найденное по стандартной шкале или калибровочному графику, мг
V - объем исследуемой воды, взятой на определение, мл.
ЛАБОРАТОРНАЯ РАБОТА №5
0ПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ ХЛОРСОДЕРДАЩИХ
СОЕДИНЕНИЙ.
Вследствие большой растворимости хлористых солей ион хлора присутствует почти во всех водах.
Наибольшей растворимостью обладают хлористый магний MgCI2 /545г/л/ и хлористый натрий NaCI / 360 г/л /.
Наличие в воде больших количеств хлоридов может быть вызвано вымыванием хлористых солей из грунта или попаданием в воду хозяйственно-бытовых стоков. Если в водоем попали сточные воды, то наряду с повышением в ней концентрации ионов хлора, наблюдается также присутствие аммиака, нитритов и повышается перманганатная окисляемость.
I.ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ СУММАРНОГО И
ОСТАТОЧНОГО АКТИВНОГО ХЛОРА.
Метод основан на окислении иодида активным хлором в кислой среде до иода, который титруют тиосульфатом натрия.
I.I. Проведение анализа.
В коническую колбу насыпают 2,5г KI, растворяют его в 1-2мл дистиллированной воды, затем добавляют 5 мл буферного раствора рН=4,5и 10мл анализируемой воды. Выделившейся иод оттитровывают 0,005 н раствором тиосульфата до появления светло-желтой окраски, после чего прибавляют 1мл 0,5%-ного раствора крахмала и раствор титрует до исчезновения синей окраски.
2.Обработка результатов.
Содержание суммарного остаточного хлора /Х/ мг/л вычисляют по формуле:
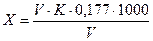 ,
,
Где: V - количество 0,005н раствора тиосульфата натрия, израсходованное на титрование, мл;
К – поправочный коэффициент нормальности раствора тиосульфата натрия,
0,177 - содержание активного хлора, соответствующее 1мл 0,005 нраствора тиосульфата натрия,
V – объем пробы воды, взятой для анализа, мл.
2. ОПРЕДЕЛЕНИЕ СВОБОДНОГО ОСТАТОЧНОГ'О
ХЛОРА.
Метод основан на окислении свободным хлором метилового оранжевого.
2.1. Проведение анализа.
10 мл исследуемой пробы воды помещают в коническую колбу, разбавляют дистиллированной водой, добавляют 2-3 капли 5 н раствора соляной кислоты и, помешивая, быстро титруют раствором 0,005%-ного метилового оранжевого до появления неисчезающей розовой окраски.
Содержание свободного остаточного хлора /Х1/ в мг/л вычисляют по формуле:
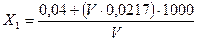 ,
,
где V - количество 0,005%-ного раствора метилового оранжевого, израсходованного на титрование, мл;
0,0217 - титр раствора матилового оранжевого,
0,04- эмпирический коэффициент,
V - oбъем воды, взятый для анализа, мл.
По разности между coдepжaнием суммарного остатка хлора, определенного иодометрическим методом, и содержанием свободного остаточного хлора, определенного методом титрования, метилоранжевым, находят содержание хлораминового хлора /Х2/ в мг/л:
Х2 = X ‑ X1.
3. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ХЛОР-ИОНА
ТИТРОВАНИЕМ АЗОТНОКИСЛЫМ СЕРЕБРОМ
Метод основан на осаждении хлор-иона в нейтральной или слабощелочной среде азотнокислым серебром, в присутствии хромовокислого калия в качестве индикатора. После осаждения хлорида серебра в точке эквивалентности образуется хромово-кислое серебро, при этом желтая окраска раствора переходит в оранжево-желтую.
Ag + Cl = AgCl
K2ClO4 + 2AgNO3 = Ag2ClO4 + 2KNO3
3.1. Качественное определение.
В пробирку наливают 5 мл воды и добавляют 3 капли 10%-ного азотнокислого серебра. Примерное содержание хлор-иона определяется по осадку или мути в соответствии с требованиями таблицы 6.
Таблица 6
| Характеристика осадка или мути | Содержание Сl, мг/л |
| 1. Опалесценсия или слабая муть 2. Сильная муть 3. Образуются хлопья, осаждаются не сразу 4. Белый объемистый осадок | 1-10 10-50 50-100 Более 100 |
3.2. Количественное определение
В зависимости от результатов качественного определения отбирают 100 мл испытуемой пробы или меньший ее объем /10-50 мл/ и доводят до 100 млдистиллированной водой. Без разбавления в пробе определяются хлориды в концентрации до 100 мг/л. Показатель рН титруемой пробы должен быть в пределах 6-10. Если вода мутная, ее фильтруют через беззольный фильтр, промытый горячей водой.
Отмеренный объем воды вносят в две конические колбы и прибавляют к ним по 1мл 5%-ногораствора хромовокислого калия. Одну пробу титруют раствором 0,1 н азотнокислого серебра до появления слабооранжевого оттенка, а вторую пробу используют в качестве контрольной.
При значительном содержании хлоридов образуется осадок AgCl, мешающий определению. В этом случае к оттитрованной пробе приливают 2-3 капли титрованного раствора NaCI до исчезновения оранжевого оттенка, затем титруют вторую пробу, пользуясь первой как контрольной. Содержание хлор-иона /X/ в мг/л вычисляют по формуле:
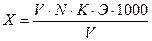 ,
,
где V - количество АgNO3, израсходованное на титрование, мл,
К - поправочный коэффициент к раствору АgNO3,
Э - миллиграмм-эквивалент хлора /35,5/,
V - объем пробы, взятой для определения, мл.
ЛАБОРАТОРНАЯ РАБОТА №6
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ СУЛЬФАТОВ
КОМПЛЕКСОНОМЕТРИЧЕСКИМ МЕТОДОМ
В природных водах наряду с ионами хлора часто встречаются и сульфатные коны (SO42-). Они попадают в воду при растворении осадочных пород, в состав которых входит гипс.
Иногда ионы SO42- образуются в результате окисления сероводорода или самородной серы. Источником сульфат-ионов могут быть также и сточные воды промышленных предприятий.
В реках и пресных озерах содержание сульфатных ионов не превышает 100 мг/л.
Присутствие сульфатов в воде в больших количествах нежелательно, т.к. сернокислый натрий Na2SO4 нарушает жизнедеятельность желудочно-кишечного тракта, a CaSO4 и сернокислый магний MgSO4 обусловливает сульфатную жесткость воды.
Метод определения концентрации сульфатных ионов основан на осаждении ионов SO42- хлористым барием. Осадок сернокислого бария растворяют в титрованном растворе трилона Б, избыток которого определяют титрованием раствором хлористого магния. Количество трилона Б, израсходованное на растворение сернокислого бария, эквивалентно количеству сульфат-ионов во взятом объеме воды.
Проведение анализа.
100 мл испытуемой воды помещают в коническую колбу вместимостью 250 мл.: В этой колбе, если необходимо, выпариванием /не доводя до кипения/ подкисленного раствора концентрируют SO42-, подливая по мере выпаривания новую порцию испытуемой воды.
Раствор подкисляют тремя каплями концентрированной соляной кислоты (докислой реакции), прибавляют 26мл 0,05 н раствора хлористого бария, нагревают до кипения, кипятят 10 мин от начала кипения и оставляют на водяной бане около 1 часа.
Через 1 час фильтруют обычным способом через небольшой беззольный фильтр "синяя лента", предварительно промытой горячей дитиллированной водой.
Фильтрование происходят, по возможности, не перенося осадок сернокислого бария на фильтр.
Колбу с осадком промывают 5-6 paз умеренно горячей водой /40-50 ° С/,не считая приставшего к стенкам колбы осадка, пропуская промывные воды через тот же фильтр.
Фильтр с частью попавшего на него осадка ВаSO4 промывают 2-3 раза водой до отрицательной реакции на CI-. Kогда вода стечет, осадок помещают в ту же колбу, в которой проводилось осаждение. Приливают 5 мл 9н раствора аммиака, фильтр осторожно разворачивают стеклянной палочкой и расправляют по дну колбы. Затем прибавляют 6 мл 0,05 н раствора трилона Б на каждые 5мг предполагаемого содержание сульфат-ионов во взятом объеме испытуемой воды для определения /70-80 мл раствора трилона Б/.
Содержимое колбы осторожно нагревают на песчаной бане до кипения и кипятят до растворения осадка /3-5 мин/, держа колбу в наклонном положении, периодически перемешивая жидкость.
Раствор охлаждают, приливают 50мл дистиллированной воды, 5 мл аммиачного буферного раствора и добавляют сухую смесь индикатора 0,1 г хромоген черного /или прибавляют 5 капель спиртового раствора индикатора/.
Избыток трилона Бтитруют раствором хлористого магния до перехода синей окраски в лиловую.
1мл 0,05 н раствора трилона Б соответствует 24 мл SO42-.
Содержание сульфатов /X/ в мг/л вычисляют по формуле:
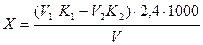 ,
,
где V1 - количествo прибавленного раствора трилона Б, мл;
K1 - поправочный коэффициент к нормальности раствора трилона Б,
V2 - количествo MgCI2, израсходованное на титрование, мл.
K2 – поправочный коэффициент к нормальности раствора MgCl2;
V - объем исследуемой воды, взятой для определения, мл.
 2015-05-26
2015-05-26 2572
2572







