Под стандартизацией раствора титранта имеют в виду установление его точной концентрации с относительной погрешностью, обычно не превышающей ± 0,1 %. Обязательным условием этой процедуры является высокая точность определения концентрации титранта.
Различают:
приготовленные
установленныерастворы титрантов.
Приготовленныерастворы получают путем растворения точной навески тщательно очищенного исходного вещества в определенном объеме воды или другого растворителя (например, раствор NaCl, K2Cr2O7). Однако многие растворы таким путем приготовить нельзя, в том числе, NaOH, KMnO4. В таких случаях готовят раствор титранта приблизительной концентрации, а потом его стандартизуют, т. е. устанавливают концентрацию с необходимой точностью. Такие растворы называют установленными. Для стандартизации титрантов применяют специальные установочные вещества, так называемые первичные стандарты.
Первичные стандарты – вещества, имеющие состав, точно отвечающий химической формуле. Они должны удовлетворять следующим требованиям:
быть устойчивы на воздухе и иметь, по возможности, большую молярную массу эквивалента;
быть доступными, легко очищаться от примесей;
реакция вещества титранта с установочным веществом должна протекать быстро, количественно и стехиометрически.
Растворы NaOH и КОН часто стандартизуют по дифталату калия КНС8Н4О4 или дигидрату щавелевой кислоты Н2С2О4 · 2Н2О.
Растворы HCl и H2SO4 стандартизуют по карбонату натрия Na2СО3 или декагидрату тетрабората натрия Na2В4О7 ·10 Н2О.
Растворы КMnO4 – по оксалату натрия Na2С2О4.
Иногда для стандартизации используют вторичные стандарты. В качестве вторичных стандартов выступают титрованные растворы веществ, способных взаимодействовать с титрантом. Например, стандартизацию раствора HCl можно сделать по титрованному раствору NaOH.
Основное правило, которое необходимо помнить: стандартизация титранта и последующее выполнение анализа необходимо проводить в одних и тех же условиях, а для стандартизации использовать то же вещество, которое будет анализироваться в дальнейшем.
Стандартные растворы готовят в мерных колбах из фиксаналов, которые содержат точно фиксированное количество вещества, обычно 0,1 моль эквивалента.
При стандартизации растворов используют: 1) метод отдельных навесок; 2) метод пипетирования.
Метод отдельных навесок
Рассчитывают массу навески стандартного вещества при условии, что расход титранта на её титрование составляет не более 20 мл. На аналитических весах взвешивают в бюксах три навески, которые могут отличаться от рассчитанной на ± 10 %. Затем их переносят точно в конические колбы для титрования, добавляют индикатор и титруют. Рассчитывают молярную концентрацию титранта для каждой навески стандартного вещества и расхождение между наибольшим и наименьшим результатами. Если расхождение не превышает 0.2 – 0.3 %, то берут среднее значение из всех трех результатов. В случае большего расхождения взвешивают еще одну навеску стандартного вещества, титруют её, находят четвертый результат и снова проверяют сходимость значений молярной концентрации
Метод пипетирования
При стандартизации растворов этим методом рассчитывают навеску стандартного вещества, необходимую для приготовления заданного объема раствора первичного стандарта с концентрацией, как правило. близкой к молярной концентрации титранта. Взвешенную на аналитических весах навеску твердого вещества количественно переносят в мерную колбу, растворяют, тщательно перемешивая. Аликвоту полученного раствора отбирают пипеткой, предварительно промытой этим раствором, в коническую колбу для титрования и титруют стандартизуемым раствором. Аликвота – порция вещества, содержащаяся в растворе, отобранном с помощью пипетки.
При стандартизации раствора титрование проводят не менее трех раз. Если объемы, затраченные на титрование, совпадают между собой в пределах 0,2 – 0,3 %, то берут из них среднее значение и рассчитывают молярную концентрацию титранта. В случае большего расхождения проводят повторное титрование.
Для приготовления стандартных растворов используют также «фиксаналы» (стандарт-титры). Фиксанал представляет собой стеклянную или пластиковую ампулу, содержащую точную навеску стандартного твердого вещества (или определенный объем титрованного раствора), необходимую для приготовления 1 литра точно 0.1 N раствора.
Кривые титрования
Кривые титрования являются важной характеристикой титриметрического метода. Они показывают графическую зависимость логарифма концентрации участника реакции, протекающей при титровании, или какого-то свойства раствора от объема добавленного титранта (или от степени оттитрованности). Например, для реакции кислотно-основного титрования: рН – V (объем титранта).
Кривая титрования служит для подбора индикатора, который позволит определить т.э. и т.к.т.
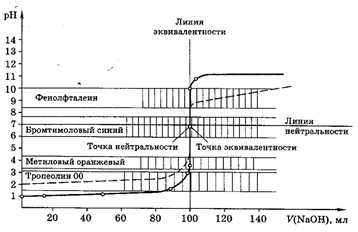
Рис 1. Кривая титрования 100,0 мл 0,1М НСl 0,1М раствором NaOH
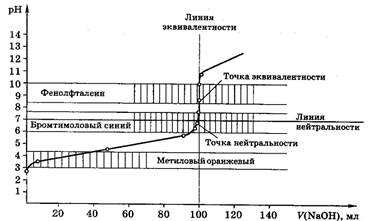
Рис 2. Кривая титрования 100,0 мл 0,1М СН3СООН 0,1М раствором NaOH
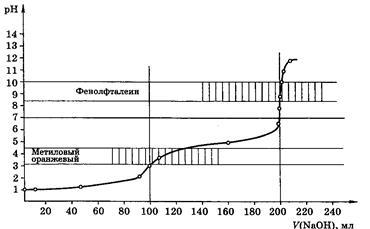
Рис 3. Кривая титрования смеси 0,1М НСl и 0,1М СН3СООН 0.1М раствором NaOH
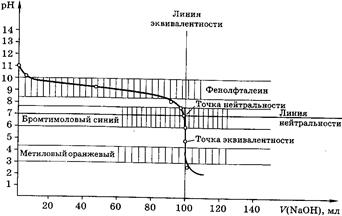
Рис 4. Кривая титрования 100,0 мл 0,1М NН3 0,1М раствором НСl
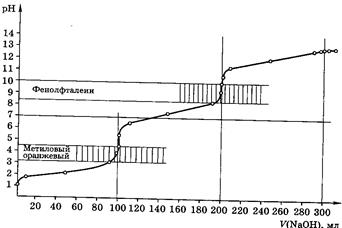
Рис 5. Кривая титрования 100,0мл 0,1М Н3РО4 0,1М раствором NaOH
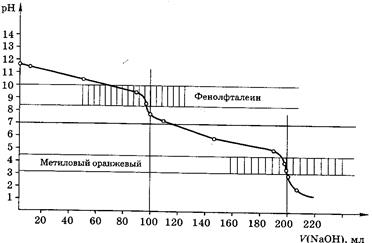
Рис 6. Кривая титрования 100,0мл 0,1М Na2СО3 0,1М раствором НСl
 2020-05-11
2020-05-11 2212
2212








