Запишем уравнение диссоциации раствора карбоната натрия (Na2CO3):
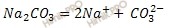
Гидролизу подвергается карбонат-ион (CO32-). Гидролиз раствора карбоната натрия (Na2CO3) проходит в две ступени.
Первая ступень:
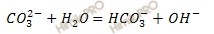
Вторая ступень:
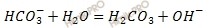
В водном растворе карбоната натрия (Na2CO3) гидролиз по второй ступени не проходит.
Для вычисления степени гидролиза необходимо вычислить молярную концентрацию раствора карбоната натрия (Na2CO3).
Найдем молярную концентрацию раствора карбоната натрия (Na2CO3) по формуле, устанавливающей связь между нормальной и молярной концентрацией:
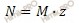
Где:
z – число эквивалентности.
Откуда молярная концентрация равна:
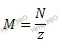
Напомню, молярная концентрацияпоказывает количество растворенного вещества (моль), содержащегося в 1 л раствора.
Учитывая, что число эквивалентности карбоната натрия (Na2CO3) равно 2 (произведение валентности металла на число его атомов в молекуле соли), рассчитаем молярную концентрацию раствора карбоната натрия (Na2CO3):
M (Na2CO3) = 0,02 / 2 = 0,01 (моль/л).
Запишем формулу нахождения константы гидролиза (Kг):
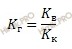
Где:
Кк - константа диссоциации слабой кислоты.
Запишем формулу нахождения степени гидролиза (h):
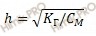
После преобразований константы гидролиза получаем:
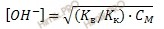
(Концентрацию гидроксид-ионов [OH-] выразили через ионное произведение воды: [OH-] = Кв/[H+]).
В данном выражении Кк – константа диссоциации гидрокарбонат-иона (HCO3-).
Хочу обратить внимание, что в расчете используется константа диссоциации угольной кислоты (H2CO3) по второй ступени.
Из справочных данных для угольно кислоты (HCO3-) находим, что константа диссоциации угольной кислоты (HCO3-) равна 4,68 ∙ 10-11.
Известные данные подставим в формулу и рассчитаем концентрацию гидроксид-ионов [OH-]:
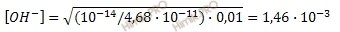
рОН = –lg 1,46 ∙ 10–3 = 2,84
рН = 14 – рОН = 14 – 2,84 =11,16
Ответ:
pH раствора карбоната натрия 11,16.
Раствор хлорноватистой кислоты (pH раствора)
Рассчитать рН раствора 0,04 М хлорноватистой кислоты (HClO).
 2015-05-26
2015-05-26 7439
7439








