РАСТВОРЫ
Дисперсными системами называются системы, состоящие из некоторого вещества, в котором в очень мелком виде распределено другое вещество. Распределенное вещество называется дисперсной фазой, а вещество, в котором распределена дисперсная фаза – дисперсионной средой. Если частицы дисперсной фазы имеют размер порядка размеров молекул (<10–8 м), то дисперсную системуРазличные типы дисперсных систем являются предметом изучения в Коллоидной химии - одном из важнейших разделов химической науки. называют раствором (истинным раствором).
Простейшие составные части раствора, которые могут быть выделены в чистом виде, называются компонентами раствора. Обычно компонент, находящийся в избытке, считают растворителем, а остальные – растворенными веществами. Если один из компонентов – вода, то ее обычно принимают за растворитель.
Концентрация – величина, выражающая относительное содержание данного компонента в растворе. Существуют следующие основные способы выражения концентрации растворов.
Массовая доля – величина, показывающая, какую долю от массы раствора составляет масса растворенного вещества:
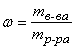 или в процентах:
или в процентах: 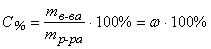
Молярная концентрация (молярность) – величина, показывающая, сколько молей растворенного вещества содержится в 1 литре раствора:
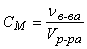 (моль/л),
(моль/л),
где nв-ва – количество растворенного вещества в растворе, моль; V р-ра – объем раствора, л.
Нормальная концентрация (нормальность, эквивалентная концентрация) – величина, показывающая, сколько эквивалентов растворенного вещества содержится в 1 литре раствора:
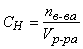 (экв/л),
(экв/л),
где n в-ва – количество растворенного вещества в растворе, экв; V р-ра – объем раствора, л.
Довольно часто химический эквивалент трактуется не как единица количества вещества, а как условная частица. Тогда n в-ва необходимо воспринимать как количество молей эквивалента.
Моляльная концентрация (моляльность) – величина, показывающая, сколько молей растворенного вещества в растворе приходится на 1 кг растворителя:
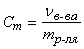 (моль/кг)
(моль/кг)
где nв-ва – количество растворенного вещества в растворе, моль; m р-ля – масса растворителя в растворе, кг.
Титр – величина, показывающая, какая масса растворенного вещества содержится в 1 мл раствора:
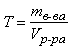 (г/мл)
(г/мл)
где m в-ва – масса растворенного вещества в растворе, г; V р-ра – объем раствора, мл.
Мольная доля вещества в растворе представляет собой отношение числа молей этого вещества к суммарному количеству молей всех компонентов раствора:
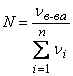 ,
,
где nв-ва – число молей компонента, для которого определяется мольная доля; n – количество компонентов раствора.
Растворимость – способность вещества растворяться в том или ином растворителе. Она характеризуется концентрацией насыщенного раствора. Растворимость часто выражают количеством граммов растворяемого вещества в 100 г растворителя. Если раствор содержит растворенного вещества больше, чем это соответствует растворимости при данной температуре, то он называется пересыщенным. Возможность существования пересыщенного раствора объясняется трудностью возникновения центров кристаллизации. В случае растворения твердых или жидких веществ в жидкостях растворимость возрастает с повышением температуры, а для газов – убывает. На растворимость газов большое влияние оказывает давление.
 2015-05-26
2015-05-26 400
400







