Вода является очень слабым электролитом, диссоциирующим по уравнению: Н2О «Н++ ОН-.
Константа диссоциации воды при 22О С равна:
Kд = 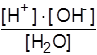 = 1,8 × 10-16.
= 1,8 × 10-16.
Доля молекул воды, диссоциированных на ионы, настолько мала, что концентрацию недиссоциированных молекул можно считать постоянной и равной числу молей воды в литре, т.е.:
[H2O] = 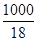 = 55,56 моль / л.
= 55,56 моль / л.
(Напомним, что молярная масса воды равна18 г/моль.)
Подставив это значение в выражение константы диссоциации и перенеся его в правую часть, получим:
[H+] × [OH-] = 1,8 × 10-16 × 55,56 = 10-14.
Эта постоянная величина называется ионным произведениемводы (КН2О); она не зависит от присутствия в воде других ионов (но зависит от температуры). Всякий водный раствор, как и чистая вода, содержит ионы Н+и ОН-и ни в каком случае [H+] или [OH-] не могут быть равны нулю, так как при этом их произведение должно обратиться в нуль.
При растворении в воде какой-либо кислоты концентрация катионов водорода [H+] увеличивается, а концентрация [OH-] должна понизиться и наоборот. Величина ионного произведения при этом постоянная [H+] × [OH-] = 10-14.
При диссоциации чистой воды [H+] = [OH-] = 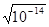 = 1 × 10-7моль / л.
= 1 × 10-7моль / л.
В кислой среде [H+] > [OH-], [H+] > 1. 10-7 моль/л и соответственно [OH-] < 1. 10-7 моль/л. Например, при [HCl] = 0,1 моль/л, рН = 1.
В щелочной среде [H+] < [OH-], [H+] < 1. 10-7 моль/л и соответственно [OH-] > 1. 10-7 моль/л. Например, при [KOH = 0,1 моль/л, рН = 13.
 2015-05-26
2015-05-26 670
670








