Массовая доля углерода в соединении равна 39,97 %, водорода 6, 73 %, кислорода 53,30 %. Масса 300 мл. (н.у.) этого соединения равна 2,41 г. Выведите молекулярную формулу этого вещества.
| Дано: w (С) = 39,97 % w (Н) = 6,73 % w (0) = 53,30 % Vн.у. (CхHуОz) = 300 мл. m (CхHуОz) = 2,41 г. | Решение: Для расчёта выбираем 100г. соединения. Тогда масса углерода равна 39,97 г; водорода 6,73 г; кислорода 53,30 г. 1. Определяем количество вещества: n (С) = 39,97г:12 г/моль = 3,33 моль n (Н) = 6,73г.: 1,008 г/моль = 6,66 моль n (0) = 53,3г.: 16 г/моль = 3,33 моль Определяем наименьшее общее кратное – 3,33. n (С): n (Н): n (0) = 1: 2: 1 Простейшая формула соединения – CH2О М (CH2О) = 30 г/моль Определяем молярную массу соединения по соотношению: 0,3 л. – 2,41 г. 22,4 л. – х г. х = (22,4 · 2,41)/0,3 = 180 Или по формуле М= Vm · m/ V К = 180: 30 = 6 Определяем молекулярную формулу соединения, умножая стехиометрические коэффициенты в простейшей формуле на 6. Ответ: искомая формула - C6H12О6 |
| Вывести формулу соединения CхНуОz-? |
12. Определите формулу углеводорода, массовая доля углерода в котором
82,2 %, а плотность этого вещества составляет 2,59 г/л.
|
|
|
13. Определите формулу красителя-анилина. По данным анилина массовая доля углерода в нем 77,4%, водорода — 7,5 %, азота — 15,1 %. Относительная плотность паров этого вещества по воздуху равна 3,21.
14. Относительная молекулярная масса исследуемого вещества равна
237, массовая доля углерода в нем составляет 10,1 %, а хлора — 89,9. Установите формулу этого хлорзамещенного углеводорода.
15. Определите молекулярную формулу предельного углеводорода, плотность которого равна 1,97 г/л, а массовая доля углерода составляет — 0,82.
16. Какова формула вещества, при анализе состава которого
установлено: массовая доля углерода в нем равна 0,52; кислорода — 0,35, а
водорода — 0,13? Относительная плотность вещества по водороду составляет
23.
17. Определите молекулярную формулу кислородсодержащего органического вещества по данным анализа: массовая доля углерода — 54,55 %; массовая доля водорода — 9,09 %.
18. Углеводород содержит в массовых долях 0,8889 или 88,89 % углерод. Его плотность по воздуху равна 1,852. Найдите молекулярную формулу этого углеводорода.
19. Определите формулу вещества, если массовая доля азота в нем 30,43%, а кислорода — 69,57 %.
20. Химический анализ показал, что в 17 г соединения алюминия с кислородом содержится 9 г алюминия. Найдите простейшую формулу этого соединения.
21. Найдите простейшую формулу оксида хрома, содержащего 68,4 % хрома.
22. Найдите простейшую формулу вещества, содержащего 43,6 % натрия, 11,3 % углерода и 45,3 % кислорода.
23. При анализе навески 3,16 мт органического вещества обнаружено, что в его составе 0,96 мт углерода, 0,12 мг водорода и 0,8 мт кальция, а остальное приходится на кислород. Найдите простейшую формулу этого соединения.
|
|
|
24. Известно, что оксид некоторого металла содержит 11,11 % кислорода и в его молекуле на один атом кислорода приходится два атом, а металла. Определите, что это за металл, и о каком соединении идет речь.
25. Найдите формулу соединения, если известно, что в его состав входи-
1,59 % водорода, 22,22 % азота, 76,19 % кислорода.
26. Дано: углерода —92,3 %, водорода — 7,7 %, масса 1 л газа при н.у. 1,16 г. Определить молекулярную формулу.
27. Хлорпроизводное предельного углеводорода имеет молекулярную массу 237. Процентный состав этого соединения следующий: хлора — 89,9 %, углерода — 10,1 %. Найдите его молекулярную формулу.
1. Найдем массу хлора
237 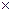 0,899 = 213
0,899 = 213
237—213 = 24
х:.у=24/12: 213/35,5=2: 6=>С2С16.
28. Определите формулы двух оксидов одного и того же элемента, если его массовая доля в этих оксидах равна 88,11 и 84,75%. Этот элемент образует также фторид, содержащий 32,47 % фтора по массе.
29. Элемент ниобий образует более двадцати галогенводородов. Установите две формулы соединений ниобия с одним из галогенов, если содержание металла в них составляет 15,47 и 21,54 % по массе.
30. Относительная плотность по водороду неизвестного газообразного вещества равна 22. Найдите молекулярную формулу этого вещества, если массовая доля (С) в нем 54,55 %, (Н) — 9,09 %, (О) — 36,36 %.31. Найдите простейшую формулу соединения, имеющего следующий состав: Nа —42,1 %, Р — 18,9 %, О — 39,0 %.
8-1. Определите молекулярную формулу органического соединения с составом 80% углерода и 20% водорода, если плотность его по воздуху равна 1,034.
8-2. Определите молекулярную формулу углеводорода, который содержит 85,7% углерода и имеет плотность по водороду 21.
8-3. Органическое вещество содержит 84,21% углерода и 15,79% водорода. Плотность паров вещества по воздуху 3,93. Определить формулу вещества.
8-4. Углеводород содержит 82,76% углерода и 17,24% водорода (по массе). При монохлорировании этот углеводород образует два изомерных алкилхлорида – первичный и третичный. Определить строение исходного углеводорода.
8-5. Органическое вещество содержит 91, 3% углерода и 8,7% водорода. Относительная плотность паров по кислороду равна 2,875. Вывести молекулярную формулу вещества.
8-6. Установите молекулярную формулу углеводорода, молекула которого содержит 40 электронов, а молекулярная масса которого 70.
8-10. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
8-11. Установите молекулярную формулу дибромалкана, содержащего 85,11% брома.
8-12. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
8-13. Монохлорпроизводное предельного углеводорода содержит 38.4% хлора. Определить формулу углеводорода.
8-14. Монохлорпроизводное предельного углеводорода содержит 38,4% хлора по массе. Определите, сколько атомов углерода содержится в молекуле этого вещества.
8-15. В монохлоралкане массовая доля хлора равна 55,04%. Определите формулу монохлоралкана.
8-16. Определите молекулярную формулу фторпроизводного алкана, в 34,27 г которого содержится 17,44 г фтора.
8-17. Определите молекулярную формулу хлорпроизводного алкана, в 35,24 г которого содержится 23,83 г хлора.
8-18. Дихлорпроизводное алкана содержит 5,31% водорода по массе. Определите молекулярную формулу дихлоралкана. Приведите структурную формулу одного из возможных изомеров и назовите его.
8-19. Вещество содержит 36.4% С, 6.1% Н и фтор. Молекулярная масса этого вещества меньше 110. Сколько всего атомов в этой молекуле?
8-20. Органическое вещество содержит 0,2424 доли углерода, 0,0404 доли водорода, 0,7172 хлора. Плотность паров по азоту составляет 3,5357. Определите химическую формулу этого вещества.
8-21. Органическое вещество содержит 0,2975 углерода, 0,0413 водорода, 0,6612 брома. Относительная плотность паров по воздуху равна 4,1724. Вывести молекулярную формулу вещества.
|
|
|
8-22. Хлорпроизводное предельного углеводорода имеет молекулярную массу 257. Процентный состав этого соединения следующий: хлор-89,9%, углерод-10,1%. Определите его молекулярную формулу.
8-23. При монохлорировании углеводорода, содержащего 83,72% С и 16,28% Н, образовалось 2 изомерных хлорпроизводных – первичное и третичное. Установите строение углеводорода, составьте формулы продуктов хлорирования
8-25. Содержание брома в соединении, полученном при взаимодействии алкена с бромом, составляет 69,56 мас.%. Определите структурную формулу алкена, если известно, что он может существовать в виде цис- и транс- изомеров.
.
15-10. Ароматическое соединение ряда бензола содержит 90.0% углерода. Нарисовать ео возможные изомеры.
15-48. Плотность по водороду вещества равна 22. Вещество имеет следующий состав: углерод - 54,55%, водород - 9,09%, кислород – 36,36% Вещество легко восстанавливает оксид серебра. Определить это вещество.
15-50. Органическое вещество природного происхождения содержит 40 мас.% углерода, 6,67 мас.% водорода и кислород. Сколько всего атомов содержит молекула этого соединения, если известно, что его молярная масса равна 180 г/моль?
15-26. В предельной одноосновной карбоновой кислоте массовая доля кислорода равна 43,24%. Определите формулу кислоты.
15-28. Предельная одноосновная карбоновая кислота содержит 48.6%С. Какая это кислота?
15-30. Установите молекулярную формулу предельной карбоновой кислоты, метиловый эфир которой содержит 9,09% водорода.
15-40. При взаимодействии первичного одноатомного спирта, содержащего 60% углерода и 13,3% водорода, с органической кислотой образовалось вещество, плотность паров которого по водороду равна
 2015-05-29
2015-05-29 10006
10006








