Атомы и химические элементы
Атом - это наименьшая химическая частица вещества.
При разрушении атом распадается на более мелкие ("элементарные") физические частицы, из которых он построен.
Число этих частиц у разных атомов различное.
Физические частицы - это электрон e −, протон p + и нейтрон n 0.
Атом электронейтрален; его ядро включает некоторое число протонов и нейтронов и заряжено положительно, а на периферии атома (в электронной оболочке) находятся электроны, общее число которых равно числу протонов в ядре.
Определенный вид атомов называется химическим элементом.
Каждый элемент имеет свое название и символ. Названия и символы всех химических элементов приведены в Периодической системе.
Химические элементы могут проявлять металлические и неметаллические свойства. В Периодической системе 22 элемента считаются неметаллами (это He, Ne, Ar, Kr, Xe, Rn, F, Cl, Br, I, At, O, S, Se, Te, N, P, As, C, Si, B, H), а остальные элементы - металлами.
Все атомы каждого элемента имеют одно и то же число протонов в ядре и число электронов в оболочке.
Относительная атомная масса
Атомы элементов характеризуются определённой (только им присущей) массой. Например, масса атома Н равна 1,67 . 10−23 г, атома С − 1,995 . 10−23 г, атома О − 2,66 . 10−23 г.
Пользоваться такими малыми значениями неудобно, поэтому введено понятие об относительной атомной массе А r − отношении массы атома данного элемента к атомной единице массы (1,6605 . 10−24 г).
Молекулы. Молекулярные формулы. Ковалентные и ионные вещества
 Молекула - наименьшая частица вещества, сохраняющая химические свойства этого вещества. Все молекулы построены из атомов и поэтому также электронейтральны.
Молекула - наименьшая частица вещества, сохраняющая химические свойства этого вещества. Все молекулы построены из атомов и поэтому также электронейтральны.
Состав молекулы передаётся молекулярной формулой, которая отражает и качественный состав вещества (символы химических элементов, входящих в его молекулу), и его количественный состав (нижние числовые индексы, отвечающие числу атомов каждого элемента в молекуле).
Так, формула молекулы воды записывается H2O (2 атома водорода, 1 атом кислорода), молекула хлора Cl2 (2 атома хлора), молекула углекислого газа - CO2 (1 атом углерода, 2 атома кислорода).
Примеры чтения молекулярных формул:
N2 - эн-два, NH3 - эн-аш-три, H2O - аш-два-о, H2SO4 - аш-два-эс-о-четыре.
Вещества, состоящие из реальных молекул, называются ковалентными веществами - например, вода H2O, аммиак NH3, азот N2, серная кислота H2SO4, этанол C2H5OH, сахароза C12H22O11.
Большинство неорганических веществ - ионные, они состоят из электронейтральных сочетаний положительных ионов (катионов) и отрицательных ионов (анионов) и не содержат молекул. Их состав передается также молекулярными формулами (условные молекулы), причем сами ионы могут быть одно- и многоэлементными. Так, фторид кальция CaF2 - сочетание одного катиона Ca2+ и двух анионов F−, а сульфат натрия Na2SO4 - сочетание двух катионов Na+ и одного аниона SO42−.
Иногда условные и реальные молекулы в целом, независимо от их ковалентного или ионного строения, называют формульными единицами веществ.
Некоторые вещества в газообразном и жидком состояниях могут образовывать ассоциаты молекул - реальные частицы вещества в конкретных физических условиях. Например, оксид фосфора(V) P2O5 может существовать в виде димера P4O10, оксид азота(IV) NO2 - в виде N2O4. Формулы P2O5 и NO2 называются молекулярными, а P4O10 и N2O4 - истинными.
Ответ 2
Относительная атомная масса. Относительная молекулярная масса
Второй важной характеристикой атома после заряда является его масса. Она называется абсолютной атомной массой – ma.
Масса атома углерода, например, равна 1,99 · 10-26 кг. Однако, выражать значения масс атомов с помощью грамм или килограмм неудобно, т.к. получаются очень малые значения, а ими тяжело пользоваться. Поэтому для вычисления атомных масс за единицу массы принимают 1/12 массы атома углерода-12. Эта единица измерения массы атома называется углеродной единицей (у.е.) или атомной единицей массы (а.е.м.):
1 а.е.м. = 1,667 · 10-27 кг = 1,667 · 10-24 г
Эта величина является основой для химических и физических расчетов.
Таким образом, относительная атомная масса – это масса атома, отнесенная к 1/12 массы атома изотопа углерода 12. Обозначается Ar (индекс «r» - начальная буква английского слова relative – относительный). Найти значение относительной атомной массы можно в таблице Менделеева рядом с каждым химическим элементом. Оно показывает во сколько раз масса данного элемента больше 1/12 массы изотопа углерода-12. Например, относительная атомная масса цинка равна 65. Это означает, что атом цинка в 65 раз тяжелее 1/12 массы атома углерода.
Между абсолютной и относительной атомными массами существует зависимость:
Ar = ma / 1а.е.м.
Следовательно, для данного химического элемента абсолютная атомная масса рассчитывается так:
Например, ma (водорода Н) = Ar(Н) * 1а.е.м. = 1 * 1,667· 10-24 = 1,667 · 10-24 г
ma (О) = Ar(О) * 1а.е.м. = 16 * 1,667· 10-24 = 26 · 10-24 г = 2,6 · 10-23 г
Для характеристики молекул можно пользоваться понятиями абсолютной mМ и относительной молекулярной массы Мr соответственно. Относительная молекулярная масса - это масса молекулы, соотнесенная к 1 а.е.м.:
Мr = mМ / 1а.е.м.
Абсолютная молекулярная масса – это масса молекулы, которая складывается из относительных атомных масс каждого из атомов, присутствующих в этой молекуле. Рассмотрим на примере, рассчитывая по формуле:
mМ (Н2О) = количество атомов (Н)*1а.е.м*Ar (Н) + количество атомов (О)*1а.е.м*Ar (О);
mМ (Н2О) = 2*1,667·10-24*1 + 1*1,667·10-24*16 = (3,334+26)*10-24 ≈ 29,334·10-24 г
Мr (Н2О) = 29,334·10-24 / 1,667·10-24 = 17,6 ≈ 18 г
Намного проще посчитать, посмотрев в периодической системе Д.И. Менделеева относительные атомные массы каждого из атомов этой молекулы и сложить их, учитывая, конечно же, количество атомов. Например, в молекуле воды Н2О 2 атома водорода, значит, мы должны значение относительной атомной массы 1 атома водорода умножить на 2 (ведь таких атомов 2 в молекуле):
Мr (Н2О) = 2*Ar(Н) + 1*Ar(О) = 2*1+16 = 18 г
Мr (Н2SО4) = 2*Ar(Н) + Ar(S) + 4*Ar(О) = 2*1+32+4*16 = 2+32+64 = 98 г
Ответ 3
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро
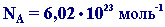
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12С:
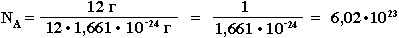
Таким образом, 1 моль вещества содержит 6,02 • 1023 частиц этого вещества.
Исходя из этого, любое количество вещества можно выразить определенным числом молей ν (ню). Например, в образце вещества содержится 12,04 • 1023 молекул. Следовательно, количество вещества в этом образце составляет:
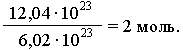
В общем виде: 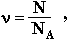
где N – число частиц данного вещества;
NA – число частиц, которое содержит 1 моль вещества (постоянная Авогадро).
Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Например, молярная масса метана CH4 определяется следующим образом:
Мr(CH4) = Ar(C) + 4 Ar(H) = 12+4 =16
M(CH4)=16 г/моль, т.е. 16 г CH4 содержат 6,02 • 1023 молекул.
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:
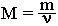
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
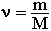
или найти массу вещества по числу молей и молярной массе:
m = ν • M
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.
Пример
Вычислить массы метана CH4 и этана С2H6, взятых в количестве ν = 2 моль каждого.
Решение
Молярная масса метана M(CH4) равна 16 г/моль;
молярная масса этана M(С2Н6) = 2 • 12+6=30 г/моль.
Отсюда:
m (CH4) = 2 моль • 16 г/моль = 32 г;
m (С2Н6) = 2 моль • 30 г/моль = 60 г.
Таким образом, моль – это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
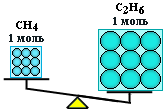
(CH4) = (С2Н6), но m (CH4) < m (С2Н6)
Вычисление ν используется практически в каждой расчетной задаче.
Ответ 4
 2015-05-30
2015-05-30 4925
4925