Материальные тела являются источниками электромагнитного излучения, имеющего разную природу. Во второй половине XIX в. были проведены многочисленные исследования спектров излучения молекул и атомов. Оказалось, что спектры излучения молекул состоят из широко размытых полос без резких границ. Такие спектры назвали полосатыми. Спектр излучения атомов состоит из отдельных спектральных линий или групп близко расположенных линий. Поэтому спектры атомов назвали линейчатыми. Для каждого элемента существует вполне определенный излучаемый им линейчатый спектр, вид которого не зависит от способа возбуждения атома.
Самым простым и наиболее изученным является спектр атома водорода. Анализ эмпирического материала показал, что отдельные линии в спектре могут быть объединены в группы линий, которые называются сериями. В 1885 г. И.Бальмер установил, что частоты 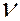 линий в видимой части спектра водорода можно представить в виде простой формулы:
линий в видимой части спектра водорода можно представить в виде простой формулы:
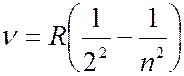 (
(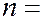 3, 4, 5, …),
3, 4, 5, …),  (7.42.1)
(7.42.1)
где 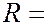 3,29∙1015 с-1 – постоянная Ридберга. Спектральные линии, отличающиеся различными значениями
3,29∙1015 с-1 – постоянная Ридберга. Спектральные линии, отличающиеся различными значениями 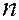 , образуют серию Бальмера. В дальнейшем в спектре атома водорода было открыто еще несколько серий:
, образуют серию Бальмера. В дальнейшем в спектре атома водорода было открыто еще несколько серий:
Серия Лаймана (лежит в ультрафиолетовой части спектра):
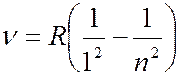 (
(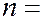 2, 3, 4, …); (7.42.2)
2, 3, 4, …); (7.42.2)
Серия Пашена (лежит в инфракрсной части спектра):
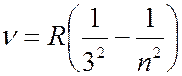 (
(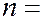 4, 5, 6, …); (7.42.3)
4, 5, 6, …); (7.42.3)
Серия Брекета (лежит в инфракрсной части спектра):
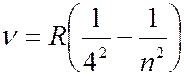 (
(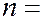 5, 6, 7, …); (7.42.4)
5, 6, 7, …); (7.42.4)
Серия Пфунда (лежит в инфракрсной части спектра):
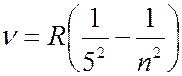 (
(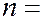 6, 7, 8, …); (7.42.5)
6, 7, 8, …); (7.42.5)
Серия Хэмфри (лежит в инфракрсной части спектра):
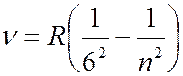 (
(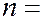 7, 8, 9, …). (7.42.6)
7, 8, 9, …). (7.42.6)
Частоты всех линий в спектре атома водорода можно описать одной формулой – обобщенной формулой Бальмера:

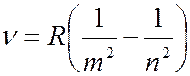 , (7.42.7)
, (7.42.7)
где 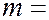 1, 2, 3, 4 и т.д. – определяет серию (например, для серии Бальмера
1, 2, 3, 4 и т.д. – определяет серию (например, для серии Бальмера 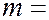 2), а
2), а 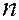 определяет линию в серии, принимая целочисленные значения, начиная с
определяет линию в серии, принимая целочисленные значения, начиная с 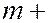 1.
1.
Из формул (7.42.1) – (7.42.7) видно, что каждая из частот в спектре атома водорода является разностью двух величин вида 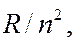 зависящих от целого числа. Выражения вида
зависящих от целого числа. Выражения вида 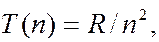 где
где 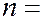 1, 2, 3, 4 и т.д. называются спектральными термами. Согласно комбинационному принципу Ритца все излучаемые частоты могут быть представлены как комбинации двух спектральных термов:
1, 2, 3, 4 и т.д. называются спектральными термами. Согласно комбинационному принципу Ритца все излучаемые частоты могут быть представлены как комбинации двух спектральных термов:
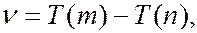 (7.42.8)
(7.42.8)
причем всегда 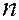 >
> 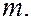
Исследование спектров более сложных атомов показало, что частоты линий их излучения можно также представить в виде разности двух спектральных термов, но их формулы сложнее, чем для атома водорода.
Установленные экспериментально закономерности излучения атомов находятся в противоречии с классической электродинамикой, согласно которой электромагнитные волны излучает ускоренно движущийся заряд. Следовательно, в атомы входят электрические заряды, движущиеся с ускорением в ограниченном объеме атома. Излучая, заряд теряет энергию в виде электромагнитного излучения. Это означает, что стационарное существование атомов невозможно. Тем не менее, установленные закономерности свидетельствовали, что спектральное излучение атомов является результатом пока неизвестных процессов внутри атома.
 2015-05-30
2015-05-30 7925
7925








