I этап — получение изолированных колоний бактерий из исследуемого материала. При выделении ЧК бактерий из испытуемого материала первоначально необходимо оценить концентрацию бактерий в материале. На I этапе выделения ЧК также осуществляют первоначальную идентификацию бактерий по морфологии и тинкториальным свойствам. Для решения этих задач из исследуемого материала
готовят фиксированный мазок, окрашивают по методу Грама (или другими методами в зависимости от цели исследования) и микроскопируют. Если количество бактерий в поле зрения велико, исследуемый материал разводят в пробирке со стерильным изотоническим раствором хлорида натрия. При малом количестве бактерий в препарате весь объем образца засевают на жидкие среды обогащения с целью увеличения концентрации бактерий. При необходимости выделения определенного вида бактерий посев осуществляют на элективные среды.
Для выделения ЧК бактерий из испытуемого материала необходимо сначала разобщить находящиеся в нем микробы разных видов. Обычно для этого посев материала производят на плотную питательную среду таким образом, чтобы получить изолированные колонии присутствующих в нем бактерий (см. выше). После посева чашку переворачивают дном кверху, подписывают и помещают в термостат при 37 °С на 18—24 ч.
Иногда применяют метод пластинчатых разводок, который заключается в перемешивании различных разведений исследуемого материала с расплавленным и остуженным питательным агаром в колбе или пробирке. После этого агар разливают в чашки Петри и инкубируют в термостате.
Разделение бактерий с использованием физических и химических факторов осуществляют следующим образом. Для выделения спорообразующих бактерий уничтожают неспорообразую-щие, прогревая исследуемый материал при 80 "С в течение 20 мин или подвергают кратковременному кипячению. Споры бактерий при этом сохраняются и при посеве прогретого материала на питательную среду прорастают. Если материал содержал только один вид спорообразующих бактерий, таким образом можно получить ЧК. Если материал содержал споры разных бактерий, дальнейшее выделение осуществляют стандартными методами.
При выделении ЧК психрофильных бактерий используют инкубацию при низких температурах, задерживающих рост сопутствующей микрофлоры. Так, например, для выделения ЧК возбудителя чумы {Yersinia pestis) посевы инкубируют при температуре около 5"С.
В ряде случаев ЧК бактерий можно получить путем подавления размножения части микробов в исследуемом материале воздействием на них факторами, к которым выделяемый вид устойчив. С этой целью используют антимикробные препараты, химические вещества и бактериофаги. В питательную среду вносят соответствующее вещество или фаг в строго определенной концентрации, препятствующей размножению сопутствующих бактерий, но не оказывающей выраженного ингибиру-ющего действия на исследуемый микроорганизм.
Кроме упомянутых, в бактериологической практике иногда применяют и другие методы. Например, для выделения чистой
 |
культуры бактерий рода Proteus (Proteus vulgaris) используют его способность к "ползучему" росту (метод Шукевича). При этом бактерии, засеянные в основание скошенного агара, за время культивирования распространяются по всей поверхности агара.
II этап — накопление ЧК для ее дальнейшей идентификации. II этап начинают с оценки результатов первичного посева материала и изучения кулыпуралъных признаков выросших бактерий — особенностей их роста на питательных средах.
Морфология микробных колоний является наиболее информативным культуральным признаком. Колонии различаются по величине, форме, цвету, консистенции, контуру края, структуре и характеру поверхности (рис. 3.1.1). По величине колонии могут быть крупные (диаметр более 4—5 мм), средние (2—4 мм) и малые (1—2 мм), по форме — круглые, розеткооб-разные, листовидные и т.д. Цвет колонии зависит от выработки определенного пигмента — белого, желтого, красного и др. Колонии непигментирующих бактерий бесцветны. По консистенции различаются сухие, влажные, сочные или слизистые колонии. Поверхность колонии бывает гладкой, морщинистой, исчерченной, плоской, выпуклой, вдавленной. Край колонии может быть ровным, волнистым, бахромчатым. Колонии могут иметь аморфную, зернистую, волокнистую внутреннюю структуру.
При получении микробного газона характер роста бактерий может быть сухим, влажным, "ползучим", складчатым, пигментированным. В жидкой питательной среде одни бактерии дают диффузное помутнение, другие характеризуются придонным или пристеночным ростом; некоторые культуры образуют пленки на поверхности среды, другие — осадок на дне пробирки, что преимущественно определяется потребностью в кислороде.
Для оценки результатов первичного посева исследуемого материала чашки с посевами просматривают и изучают морфологию выросших колоний. Для определения морфологии бактерий и их тинкториальных свойств из материала колоний разных типов готовят мазки, окрашивают по методу Грама и микроскопируют. Необходимо помнить, что родственные бактерии могут отличаться по морфологии колоний и наоборот. Материал из изолированной колонии каждого типа пересевают в отдельные пробирки со скошенным агаром или какой-либо другой питательной средой. Для этого часть колонии снимают петлей, не задевая соседние колонии, и засевают штрихом на скошенную поверхность агара в пробирку. Для выделения и накопления чистой культуры выбирают колонии только тех бактерий, которые присутствовали в исследуемом материале. Появление колоний других бактерий может быть результатом контаминации (загрязнения) посева посторонними микробами
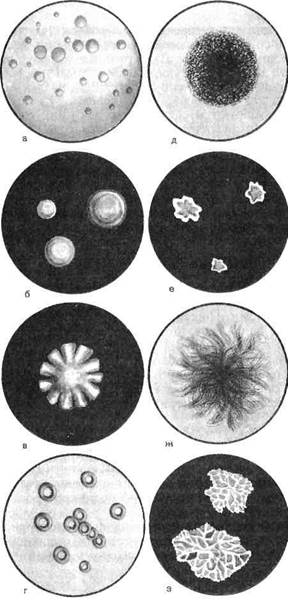
Рис.3.1.1. Типы бактериальных колоний, а — круглые с ровными краями; б — круглые, выпуклые, блестящие, слизистой консистенции; в — с неровными краями; г — круглые с валиком по периферии; Д — зернистые; е — плоские листовидные; ж — ветвистые; з — складчатые.

 вследствие недостаточно строгого соблюдения стерильных условий работы.
вследствие недостаточно строгого соблюдения стерильных условий работы.
Особенности культивирования анаэробных бактерий. Все манипуляции со строгими анаэробами должны осуществляться в бескислородных условиях. Для этого используют герметичные настольные камеры с регулируемым газовым составом среды. Посевы производят на специальные обогатительные (элективные) среды для анаэробов (тиогликолевую, Китта—Тароцци). Посевы инкубируют в специальных С02-инкубаторах или в анаэростатах (металлических или пластмассовых контейнерах, герметично закрывающихся крышкой, снабженной патрубками для заполнения газовой смесью нужного состава), которые помещают в обычный термостат. Для инкубации небольших по объему посевов (1—2 чашки Петри) применяют пластиковые пакеты, содержащие химические генераторы газовой смеси, которые обеспечивают полное удаление кислорода из воздушной среды в течение нескольких минут.
 2015-05-30
2015-05-30 2274
2274
