Нейротоксичность – это способность химических веществ, действуя на организм, вызывать нарушения структуры и/или функции нервной системы. Нейротоксиканты – вещества, для которых порог чувствительности всей нервной системы или отдельных её гистологических и анатомических образований существенно ниже, чем других органов и тканей.
Любой токсический процесс в нервной системе инициирует либо ее структурные нарушения, начиная с клеточного и молекулярного уровней (мембраны, рецепторы, ионные каналы, вторичные посредники и т.д.), либо функциональные нарушения, основными проявлениями которых является нарушение механизмов генерации, проведения и передачи нервного импульса.
Основной структурно-функциональной единицей нервной системы является нейрон, представляющий собой клетку, имеющую два отростка – аксон и дендрит. Дендрит представляет собой многократно ветвящийся короткий отросток нейрона, предназначенный для восприятия и проведения нервного импульса. Каждый нейрон может иметь один или несколько дендритов. Аксон – длинный отросток нейрона, предназначенный для проведения нервного импульса от тела нервной клетки к другим клетками, а также транспорта белков, энзимов, нейромедиаторов посредством быстрого (400 мм / день) и медленного (3 мм / день) антеградного, а также ретроградного (200 мм / день) аксонального тока.
|
|
|
Наличие отростков и системы внутриклеточного транспорта физиологически активного материала, а также питательных и пластических веществ на значительные расстояния, делают нейроны наиболее уязвимыми элементами нервной системы для действия токсикантов.
Механизмы повреждения нейронов могут носить как неспецифический, так и специфический характер (рис. 35).
Межклеточные взаимодействия в нервной системе осуществляются через синапсы – пространства между окончанием аксона и возбудимой мембраной иннервируемой клетки (нейрона, мышечной или железистой клетки). Специфическим передатчиком сигнала в синапсе является нейромедиатор или нейротрансмиттер (греч. – «жила», «веревка», «нить», позднее – «нерв»; лат: nervus – нерв, mediator - посредник, transmitto - пересылать, передавать, переправлять) – специфическое химическое вещество, выделяемое нервным окончанием, которое служит средством передачи информации (посредник в передаче информации, мессенджер) от нейрона к любым клеткам: к другому нейрону, к мышечной клетке, к клетке железы или к другим видам клеток. Потенциал действия вызывает выделение нейромедиатора из пресинаптических везикул, затем медиатор диффундирует в межсинаптическую область и связывается со специфическими рецепторами на постсинаптической мембране, запуская тем самым каскад процессов в иннервируемой клетке, сопровождающийся изменением ее функционального состояния (активацию или угнетение) (рис. 36).
|
|
|
По химической структуре нейротрансмиттеры можно разделить на пять классов: 1) аминокислоты, 2) амины и их производные, 3) нейропептиды, 4) нуклеозиды и нуклеотиды, 5) стероиды (табл. 22). Последние два класса пока представлены единичными веществами.
Таблица 22 – Основные нейромедиаторы (Koolman, Color Atlas of Biochemistry, 2nd ed., 2005)
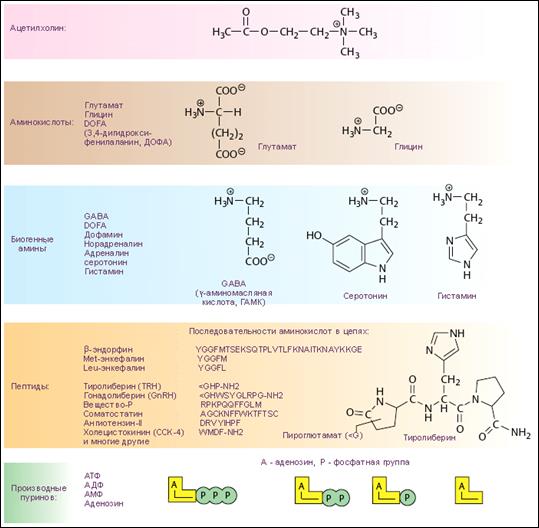
В 1924 г. А.Ф. Самойлов впервые сформулировал химический принцип передачи нервного возбуждения в его общей форме. В настоящее время в ЦНС и на периферии идентифицировано более 17 типов нейромедиаторных систем: холинергическая (мускариночувствительная – 4 подтипа, никотиночувствительная – 2 подтипа), ГАМК-ергическая (2 подтипа), глутаматергическая (4 подтипа), дофаминергическая (1подтип), серотонинергическая (5 подтипов), опиоидная (4 подтипа) пептидергическая (более 5 подтипов), гистаминергическая (3 подтипа), пуринергическая (6 подтипов) и.т.д. Ацетилхолин - один из первых изученных медиаторов. Он чрезвычайно широко распространен в нервной периферической системе. Синаптические структуры, в которых медиаторную функцию выполняет ацетилхолин обнаружены как в ЦНС, так и на периферии. Физиологически важное различие между М-холинорецепторами и Н - холинорецепторами - в скорости ответа на приходящий сигнал. Никотиновые рецепторы обеспечивают быструю передачу и непродолжительные эффекты, тогда как М-холинорецепторы действуют более медленно и длительно. Объясняется это тем, что Н-холинорецепторы относятся к быстродействующим ионотропным рецепторам. Изменение конформации белковой молекулы в результате активации Н – холинорецептора и вызывает открытие ионных каналов для Na+ и К+. Открывшийся на несколько миллисекунд при контакте с АХ такой канал успевает пропустить ионы Na+ и К+.
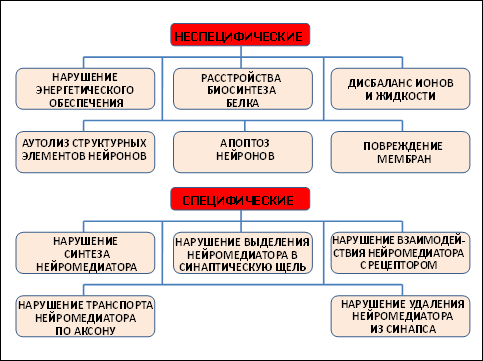
Рис. 35 – Механизмы токсического повреждения нейронов
γ – аминомаслянная кислота (ГАМК) – основной нейромедиатор, регулирующий процессы торможения в ЦНС. ГАМК широко распространена в ЦНС млекопитающих, она выявляется в 50% всех нервных окончаний мозга. Секретируемая в синаптическую щель ГАМК после взаимодействия с рецепторами транспортируется в глиальные клетки здесь она превращается в глутамат, затем в глутамин, который возвращается в нейроны и служит предшественником для синтеза новых молекул ГАМК. Однако основной путь инактивации ГАМК – нейрональный захват его пресинаптическим окончанием. Однако роль ГАМК не сводится исключительно к угнетению возбуждения в ЦНС. Тонические тормозные входы могут трансформировать активность целевых клеток, обеспечивая пространственную и временную интеграцию возбудительных входов, что лежит в основе механизма обработки информации. Контролируя временные параметры множества разрядов множества клеток, тормозные нейромедиаторы синхронизируют активность нейронных популяций и даже усиливают эффект возбудительных входов.
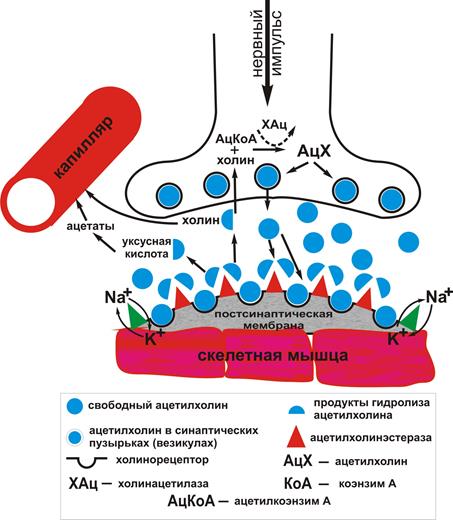
Рис. 36 – Схематическое изображение холинергического синапса
Катехоламины адреналин, норадреналин и дофамин синтезируются в мозговом веществе надпочечников, в симпатической нервной системе и в мозге. Их биологическая активность заключается в способности воздействовать на функциональное состояние органов и систем, а также на интенсивность метаболических процессов в тканях. Катехоламины возбуждают деятельность ЦНС, вызывают учащение и усиление сокращений сердца, расслабление гладких мышц кишечника и бронхов, увеличивают или снижают периферическое сопротивление кровеносных сосудов, стимулируют гликогенолиз и липолиз, повышают интенсивность азотистого обмена, влияют на процессы переноса ионов натрия, калия, кальция через клеточные мембраны. Физиологические эффекты этих нейромедиаторов обусловлены их способностью связываться со специфическими чувствительными к катехоламинам образованиями мембраны эффекторной клетки – адренорецепторами и через них воздействовать на адренореактивные системы клеток.
|
|
|
Адреналин (эпинефрин) – гормон мозгового вещества надпочечников, синтезируется, в основном, в хромаффинных клетках мозгового вещества надпочечников из дофамина и норадреналина. Поступая в кровоток, он действует на клетки отдаленных органов. Уровень адреналина в крови характеризует гуморальную часть симпатической нервной системы. Секреция адреналина и выброс его в кровь усиливаются в тех случаях, когда необходима срочная адаптивная перестройка обмена веществ (например, при стрессе, гипогликемических состояниях и др.). Адреналин проявляет в основном так называемые метаболические эффекты — он повышает потребление тканями кислорода, концентрацию глюкозы в крови, увеличивает скорость и объем кровотока в печени.
Плазменный норадреналин происходит из симпатических нервных окончаний. Значительная его часть поглощается нейронами, а 10-20% - попадает в кровь. Только очень небольшая часть норадреналина в крови происходит из мозгового слоя надпочечников. Норадреналин отличается от адреналина более сильным сосудосуживающим действием, меньшим стимулирующим влиянием на сокращение сердца, слабым влиянием на обмен веществ (отсутствие выраженного гипергликемического эффекта). Уровень норадреналина в крови характеризует активность нейронов симпатической нервной системы.
Дофамин – медиатор симпатоадреналовой системы, один из медиаторов возбуждения в синапсах ЦНС, биосинтетический предшественник норадреналина и адреналина. Дофамин синтезируется в хромаффинных клетках тканей человека и высших животных из диоксифенилаланина — ДОФА. Важную роль в синтезе и секреции дофамина играет активность обратного нейронального захвата дофамина, секретированного в синаптическую щель. Этот процесс может блокироваться фенамином, антихолинергическими и антигистаминными препаратами, некоторыми веществами, применяемыми для лечения паркинсонизма. Дофамин участвует в регуляции секреции катехоламинов.
|
|
|
Дофамин вызывает повышение сердечного выброса, расширение кровеносных сосудов почек и усиление почечного кровотока, увеличение клубочковой фильтрации, диуреза, экскреции с мочой калия и натрия, улучшает кровоток в брыжеечных и венечных сосудах сердца, способен оказывать и сосудорасширяющее действие. Стимулируя гликогенолиз и подавляя утилизацию глюкозы тканями, дофамин вызывает повышение концентрации глюкозы в крови. Он стимулирует образование соматотропного гормона и его концентрацию в крови, но тормозит секрецию пролактина.
Серотонин – биогенный амин, один из основных нейромедиаторов в ЦНС, контролирующий аппетит, сон, настроение и эмоции человека. Физиологические функции серотонина чрезвычайно многообразны. При снижении серотонина повышается чувствительность болевой системы организма, то есть даже самое слабое раздражение отзывается сильной болью. Серотонин облегчает двигательную активность, участвует в регуляции сосудистого тонуса. Наряду с дофамином этот нейромедиатор участвует в механизмах гипоталамической регуляции гормональной функции гипофиза.
Серотонин играет важную роль в процессах свёртывания крови. Тромбоциты крови содержат значительные количества серотонина и обладают способностью захватывать и накапливать серотонин из плазмы крови. Серотонин повышает функциональную активность тромбоцитов и их склонность к агрегации и образованию тромбов. Выделение серотонина из повреждённых тканей является одним из механизмов обеспечения свёртывания крови по месту повреждения.
Серотонин участвует в процессах аллергии и воспаления: повышает проницаемость сосудов, усиливает хемотаксис и миграцию лейкоцитов в очаг воспаления, увеличивает содержание эозинофилов в крови, усиливает высвобождение других медиаторов аллергии и воспаления. Также высокий уровень содержания серотонина отмечается в кишечнике. Серотонин играет важную роль в регуляции моторики и секреции в желудочно-кишечном тракте, усиливая его перистальтику и секреторную активность. Кроме того, серотонин играет роль фактора роста для некоторых видов симбиотических микроорганизмов, усиливает бактериальный метаболизм в толстой кишке. Сами бактерии толстой кишки также вносят некоторый вклад в секрецию серотонина кишечником, поскольку многие виды симбиотических бактерий обладают способностью декарбоксилировать триптофан. При дисбактериозе и ряде других заболеваний толстой кишки продукция серотонина кишечником значительно снижается. Массивное высвобождение серотонина из погибающих клеток слизистой желудка и кишечника при воздействии цитотоксических химиопрепаратов является одной из причин возникновения тошноты и рвоты, диареи при химиотерапии злокачественных опухолей.
Гистамин является биогенным соединением, образующимся в организме при декарбоксилировании аминокислоты гистидина. Гистамин является одним из эндогенных факторов (медиаторов), участвующих в регуляции жизненно важных функций организма и играющих важную роль в патогенезе ряда болезненных состояний. В обычных условиях гистамин находится в организме преимущественно в связанном, неактивном состоянии. При различных патологических процессах (анафилактический шок, ожоги, отморожения, сенная лихорадка, крапивница и другие аллергические заболевания), а также при поступлении в организм некоторых токсикантов количество свободного гистамина увеличивается. «Либераторами» гистамина являются d-тубокурарин, морфин, йодсодержащие рентгеноконтрастные препараты, высокомолекулярные соединения (полиглюкин и др.) и другие лекарственные средства. Свободный гистамин обладает высокой активностью: он вызывает спазм гладких мышц (включая мышцы бронхов), расширение капилляров и понижение АД; застой крови в капиллярах и увеличение проницаемости их стенок вызывает отек окружающих тканей и сгущение крови. В связи с рефлекторным возбуждением мозгового вещества надпочечников выделяется адреналин, суживаются артериолы и учащается частота сердечных сокращений. Гистамин вызывает усиление секреции желудочного сока. Некоторое количество гистамина содержатся в ЦНС, где, как предполагают, он играет роль нейромедиатора. Не исключено, что седативное действие некоторых липофильных антагонистов гистамина (проникающих через гематоэнцефалический барьер противогистаминных препаратов, например димедрола) связано с их блокирующим влиянием на центральные гистаминовые рецепторы. В организме существуют специфические рецепторы, для которых гистамин является естественным лигандом. В настоящее время различают три подгруппы гистаминовых (Н) рецепторов: Н1-, Н2- и Н3-рецепторы. Возбуждение периферических Н-рецепторов сопровождается спастическим сокращением бронхов, мускулатуры кишечника и другими явлениями. Наиболее характерным для возбуждения Н2-рецепторов является усиление секреции желудочных желез. Они участвуют также в регуляции тонуса гладких мышц матки, кишечника, сосудов. Вместе с Н1-рецепторами Н2-рецепторы играют роль в развитии аллергических и иммунных реакций. Н2-рецепторы участвуют также в медиации возбуждения в ЦНС. В последнее время стали придавать большое значение стимуляции Н3-рецепторов в механизме центрального действия гистамина.
Нейротоксиканты вызывающие преимущественно функциональные нарушения со стороны нервной системы, даже при смертельных острых отравлениях не вызывают видимой альтерации нервной ткани. Среди таких нейротоксикантов выделяют две основные группы:
1. Нервно-паралитического действия.
2. Психодислептического действия.
Яды, вызывающие при отравлении приступы острого удушья и конвульсии, называются нервно-паралитическими. К числу химических групп с таким отравляющим действием можно отнести:
1. Фосфорорганические отравляющие вещества (зарин, зоман, VX).
2. Производные карбаминовой кислоты (пропуксор, альдикарб, диоксакарб и др.).
3. Бициклофосфаты (бутилбициклофосфат, изопропилбициклофосфат и др.).
4. Производные гидразина (гидразин, диметилгидразин и т.д.).
5. Сложные гетероциклические соединения (тетродотоксин, сакситоксин, норборнан и др).
6. Белковые токсины (ботулотоксин, тетанотоксин). В военной токсикологии и токсикологии экстремальных ситуаций наибольший интерес представляют ФОВ, карбаматы и белковые токсины.
Психодислептическими ОВ принято называть большую группу химически разнородных веществ, которые способны в незначительных дозах вызывать заметные изменения психики по типу острых психозов. Психодислептическим называется токсическое действие химических веществ, сопровождающееся нарушением процессов восприятия, эмоций, памяти, обучения, мышления и формированием состояния, характеризующегося неадекватными поведенческими реакциями личности на внешние раздражители. Изменения психики после однократного воздействия психодислептиков могут длиться от нескольких минут до нескольких суток.
К нейротоксикантам психодислептического действия относят несколько групп веществ:
I группа: вещества, имеющие структурное родство с серотонином (ДЛК, псилоцин, псилоцибин, ибогаин, гармалин).
II группа: вещества, структурно родственные адреналину (мескалин, амфетамин) и метаболиты адреналина (адренохром, адренолютин).
III группа состоит из 2 подгрупп:
А. Вещества, имеющие структурное родство с ацетилхолином (ФОВ, эзерин, прозерин).
Б. Вещества, обладающие холинолитическим действием (атропин, BZ, дитран, бенактизин).
IV группа: вещества растительного происхождения (марихуана, план, гашиш, ганджа, шарас, кава-кава, индийская конопля). Действующее начало этой группы — каннабинол, имеющий структурное сродство с кортикостероидами.
Потенциальную угрозу использования в качестве боевых отравляющих веществ и диверсионных ядов из группы психодислептиков представляют ДЛК и BZ.
Таким образом, нейротоксические вещества, вызывающие преимущественно функциональные нарушения со стороны нервной системы избирательно повреждают механизмы проведения и передачи нервного импульса, характеризуются двумя основными патологическими симптомокомплексами:
- нервно-паралитическим с клиникой приступов острого удушья и конвульсий, из которых потенциальную опасность массового поражения имеют ФОВ;
- психодислептическим с клиникой изменения психики по типу острых психозов, из которых наиболее типичными представителями являются ДЛК и BZ.
 2015-05-30
2015-05-30 3597
3597
