Методов измерения абсолютных значений электродного потенциала не существует, поэтому принято электродным потенциалом называть ЭДС между данным электродом и электродом сравнения.
Электроды сравнения должны характеризоваться стабильным, быстроустанавливаюшимся, известным, хорошо воспроизводимым потенциалом.
В водных растворах в качестве электрода сравнения общепринят водородный электрод, потенциал которого в стандартных условиях (концентрация кислоты 1 моль/л, температура 25°С, давление 1,013×105 Па) принят за ноль.
В общем случае потенциал водородного электрода определяется уравнением
Е = Ео н+/ н2 + 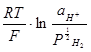 .
.
В прецизионных измерениях необходимо учитывать упругость паров воды и отклонения давления от 1 атм. При 25°С обе поправки не превышают 0,001 В. С ростом температуры резко возрастает упругость паров воды.
Водородный электрод представляет собой платиновый электрод, помещенный в 1 моль Н2SО4, омываемый газообразным водородом при давлении 1 атм. Это классический, надежный электрод сравнения, но громоздкий в работе.
В практике более предпочтительны электроды сравнения П рода: каломельный, хлорсеребряный, - обладающие устойчивым, хорошо воспроизводимым и известным потенциалом.
 2015-05-22
2015-05-22 621
621








